
| A. | 单质的沸点:X>Z | B. | X与W形成的化合物中只有极性键 | ||
| C. | 阴离子的还原性:W>X | D. | W、X、Y 可形成三元离子化合物 |
分析 W、X、Y、Z 是四种短周期非金属元素,原子序数依次增大,X、Y原子核外L电子层的电子数之比为3:4,且Y的原子半径大于X的原子半径,可知X为第二周期元素,Y为第三周期元素,则X的L层电子数为6,X为O元素,X、Y、Z的最外层电子数之和为16,Y、Z的最外层电子数之和为16-6=10,且均为非金属元素,Y为Si时Z为S符合,W的简单离子W-能与水反应生成单质w2,则W为H,以此来解答.
解答 解:由上述分析可知,W为H,X为O,Y为Si,Z为S,
A.常温下S为固体,氧气为气体,则单质的沸点:X<Z,故A错误;
B.X与W形成的化合物结构式为H-O-O-H时,含O-H极性键、O-O非极性键,故B错误;
C.非金属性O>H,则阴离子的还原性:W>X,故C正确;
D.W、X、Y只能形成硅酸、原硅酸等共价化合物,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、非金属元素等来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,W为H为解答的难点,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | H | R | ||
| 4 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 变化过程 | 破坏的作用力 |
| A | 干冰升华 | 分子间作用力 |
| B | 钠熔化 | 金属键 |
| C | 氢氧化钠的溶解 | 离子键 |
| D | 水汽化 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
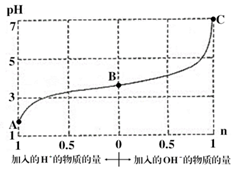 某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图.下列说法不正确的是( )
某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图.下列说法不正确的是( )| A. | A、B、C三点所表示的溶液中水的电离程度依次增大 | |
| B. | 加入1 mol NaOH后,溶液中c(Na+)=c(R-) | |
| C. | 通入HCl,R-的水解程度增大,HR的电离常数减小 | |
| D. | 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素原子半径大小为:X>Y>Z>W | |
| B. | 氧化物的水化物的酸性:Z>W | |
| C. | W与Y可形成一种硬度很大的化合物 | |
| D. | W、X、Y三种元素均可以与Z元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①②③④ | C. | ①③④⑤⑥ | D. | 全部都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 L 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目为0.2NA | |
| B. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA | |
| C. | 标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA | |
| D. | 理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外线路通过电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L H2所含原子数为2NA | |
| B. | 100mL 1.0mol•L-1的碳酸钠溶液中,CO32-数目为0.1NA | |
| C. | 1mol S在O2中充分燃烧时,转移的电子数为6NA | |
| D. | 1mol Mg和二氧化碳反应失去电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com