
【题目】锂—空气电池是一种新型的二次电池,其放电时工作原理如图所示,下列说法正确的是()
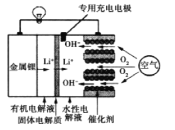
A.该电池放电时,正极的反应式为O2+4e-+4H+=2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-=Li
C.放电时电子由空气极经导线向金属锂电极移动
D.充电时,空气极与直流电源正极相连
【答案】D
【解析】
根据图示,放电时,Li作负极,发生氧化反应:Li- e—= Li+,通入空气的一极为正极,发生还原反应:O2+4e-+2H2O=4OH-,充电时,正极变阳极,与电源正极相连,负极变阴极,与电源负极相连,电极反应为放电的逆过程,据此分析解答。
A.根据题意,正极的反应式为O2+4e-+2H2O=4OH-,故A错误;
B.电池充电时,阴极得电子,发生还原反应:Li++e—=Li,故B错误;
C.电池放电时,电子从负极流向正极,金属锂为原电池的负极,应该从金属锂电极流向空气极,故C错误;
D.放电时,空气极为原电池的正极;充电时,空气极为电解池的阳极,因此充电时,空气极与直流电源正极相连,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 | I的还原性强于Cl |
B | 向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去 | 该气体一定是乙烯 |
C | 测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大 | C的非金属性比Si强 |
D | 向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 | 1-溴丙烷没有水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该物质的说法正确的是( )![]()

A.该物质的分子式为C16H18O3
B.该物质分子中的所有原子可能共平面
C.滴入KMnO4溶液,可观察到紫色褪去,证明结构中存在碳碳双键
D.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol、7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL 0.1mol/L NaOH溶液中加入0.1mol/L一元酸HA溶液后PH的变化如图所示。下列说法正确的是( )
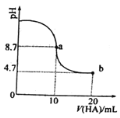
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上氦元素主要以4He 形式存在,月球上氦元素主要以3He形式存在,已知一个12C原子的质量为a g,一个3He 原子的质量为b g,一个4He 原子的质量为c g 。现有:
①3He、4He的化学性质基本相同 ②3He、4He具有相同的中子数 ③氦元素的相对原子质量为![]() ④3He、4He为氦元素的同位素,同温同压下密度之比为b:c。其中正确的是( )
④3He、4He为氦元素的同位素,同温同压下密度之比为b:c。其中正确的是( )
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )

A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO.其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100mL溶液中取出25.00mL溶液,用0.1molL-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示.在B容器中生成硝酸的物质的量为_________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________mL。
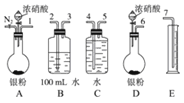
(2)测定NO的体积
①从如图3所示的装置中,你认为应选用_________装置进行Ag与浓硝酸反应实验,选用的理由是_________。
②选用如图3所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中_________(填“有”或“没有”)NO产生,作此判断的依据是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com