
| A. | 4.5mol HCl | B. | 2.5mol H2O | ||
| C. | 108.5g 33.6%的盐酸 | D. | 145g 50.3%的盐酸 |
分析 若用石墨做电极电解饱和食盐水,阳极上是氯离子失电子的氧化反应,随后是氢氧根离子失电子的氧化反应,在阴极上是氢离子得电子的还原反应,根据电子守恒,以及电解质复原的方法:出什么加什么,出多少加多少来计算回答.
解答 解:若用石墨做电极电解饱和食盐水,阳极上是氯离子失电子的氧化反应:2Cl--2e-=Cl2↑,随后是氢氧根离子失电子的氧化反应4OH--4e-=O2↑+2H2O,在阴极上是氢离子得电子的还原反应:2H++2e-=H2↑,阴极收集到4.5mol气体,即产生的氢气是4.5mol,转移电子是9mol,在阳极上收集到2.5mol气体,所以生成氯气是0.5mol,生成氧气是2mol,所以电解实质是电解氯化氢和水,根据Cl元素守恒,电解掉的盐酸是1mol,根据水的电解原理,2H2O~O2↑,产生2mol氧气需要电解4mol水,要使电解后溶液恢复到原状态,应加入1molHCl和4mol水,故AB错误;108.5g 33.6%的盐酸中含有HCl是$\frac{108.5×33.6%g}{36.5g/mol}$≈1mol,含水的物质的量是$\frac{108.5(1-33.6%)g}{18g/mol}$≈4mol,符合要求,故C正确;145g 50.3%的盐酸含有HCl的物质的量是$\frac{145g×50.3%}{36.5g/mol}$≈2mol,不符合题意,故D错误.
故选C.
点评 本题考查电解原理,难度中等,掌握离子放电顺序以及电解质复原的方法:出什么加什么,出多少加多少来是解题的关键,注意基础知识的积累掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
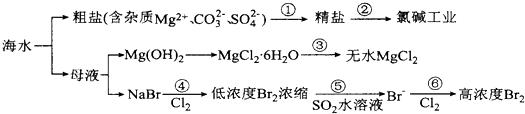
| A. | 过程①的提纯是化学过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O直接灼烧得不到MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 据央视《每周质量报告》3•15节目《“健美猪”真相》报道,河南孟州等地养猪场采用违禁动物药品“瘦肉精”饲养,“瘦肉精”之一盐酸克伦特罗在全世界养猪业中的使用都是违法的,最近美国FDA批准的盐酸莱克多巴胺(另一种瘦肉精)在猪中使用后,美国养猪户在使用前后有“黑夜与白天的差别”,菜克多巴胺其结构简式如下图,以下叙述中不正确的是( )
据央视《每周质量报告》3•15节目《“健美猪”真相》报道,河南孟州等地养猪场采用违禁动物药品“瘦肉精”饲养,“瘦肉精”之一盐酸克伦特罗在全世界养猪业中的使用都是违法的,最近美国FDA批准的盐酸莱克多巴胺(另一种瘦肉精)在猪中使用后,美国养猪户在使用前后有“黑夜与白天的差别”,菜克多巴胺其结构简式如下图,以下叙述中不正确的是( )| A. | C18H23NO3 | |
| B. | 莱克多巴属于芳香族化合物 | |
| C. | 每摩尔菜克多巴胺能与3mol NaOH反应 | |
| D. | 莱克多巴胺可燃,燃烧时产可能产生有毒氮氧化物气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,根据已有知识判定下列说法不正确的是( )
,根据已有知识判定下列说法不正确的是( )| A. | 它可使KMnO4溶液褪色 | |
| B. | 加入FeCl3溶液,能发生显色反应 | |
| C. | 它可以发生银镜反应 | |
| D. | 它被催化加氢后最终产物的化学式为C10H22O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂具有氧化性,还原剂具有还原性 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热 | |
| B. | 化学反应一定有能量变化 | |
| C. | 吸热反应一定需要加热后才能发生 | |
| D. | 化学反应热效应数值与反应物质多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl中含有杂质Na2SO4(硝酸钡) | |
| B. | FeSO4中含有杂质CuSO4(铁粉) | |
| C. | CO2中含有少量HCl气体(碳酸氢钠溶液) | |
| D. | CO2中含有少量的CO(灼热的氧化铜) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com