

 .
. 分析 由合成路线可知,反应①为光照条件下的取代反应,反应②为NaOH/醇条件下的消去反应生成A为 ,A发生反应③为烯烃与氯气加成生成B为
,A发生反应③为烯烃与氯气加成生成B为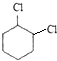 ,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为
,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为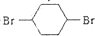 ,反应⑦NaOH/水条件下的水解反应生成对环己二醇,据此答题.
,反应⑦NaOH/水条件下的水解反应生成对环己二醇,据此答题.
解答 解:由合成路线可知,反应①为光照条件下的取代反应,反应②为NaOH/醇条件下的消去反应生成A为 ,A发生反应③为烯烃与氯气加成生成B为
,A发生反应③为烯烃与氯气加成生成B为 ,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为
,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为 ,反应⑦NaOH/水条件下的水解反应生成对环己二醇,
,反应⑦NaOH/水条件下的水解反应生成对环己二醇,
(1)A为 ,A中所含有的官能团名称为碳碳双键,故答案为:碳碳双键;
,A中所含有的官能团名称为碳碳双键,故答案为:碳碳双键;
(2)根据上面的分析可知,反应⑦NaOH/水条件下的水解反应生成对环己二醇,故答案为:水解反应(取代反应);
(3)B为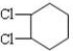 ,在NaOH醇溶液中加热发生消去反应,反应的方程式为
,在NaOH醇溶液中加热发生消去反应,反应的方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,题目难度不大,注意把握有机物的官能团与性质的关系即可解答,明确反应条件与反应类型的关系是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | 水是弱电解质 | B. | 4℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合液的pH |
| ① | 0.2 | 0.1 | pH>7 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.1 | pH=9 |
| A. | 由实验①可知,HA为弱酸 | |
| B. | 实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 实验②所得混合溶液:c(Na+)=c(A-) | |
| D. | 实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | HCl的水溶液中存在H+和Cl- | HCl是离子化合物 |
| ② | NO2通入水中,发生反应,产物中有HNO3 | NO2是酸性氧化物 |
| ③ | 向FeCl3溶液中加入铜片,溶液逐渐变为蓝色 | 氧化性:Fe3+>Cu2+ |
| ④ | 等物质的量的Na和Al都完全反应,Al失电子多 | 金属性:Al>Na |
| ⑤ | 某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①② | B. | ①②④ | C. | ③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com