
| A. | 还原产物为NH4+ | |
| B. | 若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ | |
| C. | Fe3+和Fe2+分别属于反应物和生成物 | |
| D. | 氧化剂与还原剂的物质的量之比为1:8 |
分析 亚铁离子具有还原性,酸性条件下硝酸根离子具有强氧化性,二者发生氧化还原反应生成铁离子、铵根离子,其反应方程式为8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、硝酸根离子是氧化剂,
A.氧化剂对应的产物是还原产物;
B.若把该反应设计为原电池,负极上失电子发生氧化反应;
C.根据反应方程式判断;
D.该反应中亚铁离子是还原剂、硝酸根离子是氧化剂.
解答 解:亚铁离子具有还原性,酸性条件下硝酸根离子具有强氧化性,二者发生氧化还原反应生成铁离子、铵根离子,其反应方程式为8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、硝酸根离子是氧化剂,
A.氧化剂对应的产物是还原产物,亚铁离子是还原剂、硝酸根离子是氧化剂,所以还原产物是NH4+,故A正确;
B.若把该反应设计为原电池,负极上失电子发生氧化反应,电极反应式为Fe2+-e-=Fe3+,故B正确;
C.根据方程式知,Fe3+和Fe2+分别属于生成物和反应物,故C错误;
D.该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、硝酸根离子是氧化剂,氧化剂和还原剂的物质的量之比为1:8,故D正确;
故选C.
点评 本题考查氧化还原反应,侧重考查学生分析、推断能力,正确判断反应物、生成物是解本题关键,能正确写出相应的离子方程式,题目难度中等.


科目:高中化学 来源: 题型:解答题
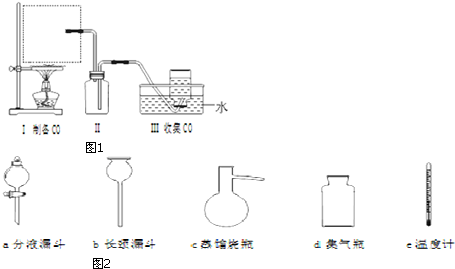
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| B. | -OH与OH-组成元素相同,含有的电子数也相同 | |
| C. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | |
| D. | 中和热测定实验中,不能用铜丝搅拌棒代替环形玻璃搅拌棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加KNO3的次数 | 1 | 2 | 3 | 4 |
| 加KNO3的质量(g) | 15 | 30 | 45 | 60 |
| 所得溶液质量(g) | 115 | 130 | 145 | 145 |
| A. | 该温度下KNO3的溶解度为45g | |
| B. | 第2次加入KNO3后所得溶液为不饱和溶液 | |
| C. | KNO3属于易溶的盐 | |
| D. | 第4次加入KNO3后所得溶液的质量分数为45% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
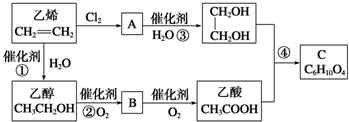
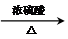 CH3COOCH2-CH2OOCCH3+2H2O.
CH3COOCH2-CH2OOCCH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:
云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲配制1L 1mol/L的NaCl溶液,可将58.5g NaCl溶于1 L水中 | |
| B. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 | |
| C. | 实验室制取乙酸乙酯时药品的加入顺序依次为浓硫酸、乙醇、乙酸 | |
| D. | 在制备Fe(OH)2时,把吸有NaOH溶液的胶头滴管插入FeSO4溶液的液面下,挤压胶头滴管,滴滴入NaOH溶液,能较长时间地观察到白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com