
【题目】己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( ) 
A.可以用有机溶剂萃取
B.1mol该有机物可以与5mol Br2发生反应
C.可与NaOH和NaHCO3发生反应
D.1mol该有机物可以与7mol H2发生反应
【答案】C
【解析】解:A.该物质为有机物,由相似相容原理可知,可以用有机溶剂萃取,故A正确;
B.酚﹣OH的邻对位能与溴水发生取代,C=C与溴水发生加成反应,则1mol该有机物可以与5mol Br2发生反应,故B正确;
C.酚﹣OH能与NaOH溶液反应,但不与NaHCO3发生反应,故C错误;
D.苯环及C=C均能与氢气发生加成反应,则1mol该有机物可以与7mol H2发生反应,故D正确;
故选C.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10﹣5 | K1=4.3×10﹣7 | K1=9.1×10﹣8 | K1=7.5×10﹣3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 . 实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL﹣1、0.001molL﹣1 , 每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL﹣1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL﹣1KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? . (填“行”或“不行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法不正确的是
A. 在标准状况下,11.2LC3H8中共价键数目为5NA
B. 1molN2和3molH2充分反应后,容器中分子总数大于2NA
C. 18gOH-和20g-OH所含电子数目相同
D. 氯气通入到FeI2溶液中,当有3NAFe2+被氧化时,消耗标准状况下氯气336L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大。X元素原子的半径最小。Z、W在周期表中处于邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层子数的2倍。请回答:
(1)Z2的电子式为___________,YW2的结构式为____________。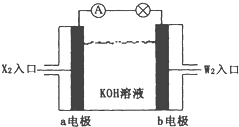
(2)将X2、W2按上图所示通入某燃料电池中,其中,b电极的电极反应式为__________________。若有16gW2参加反应,转移的电子数是____________。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐_______(化学式),与足量的NaOH溶液在加热条件下反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】75号元素铼,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰与铼处于同一族,锰原子价层电子的轨道表示式(价层电子排布图)为_______,它处于周期表的_____区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是___________________________。
②配位体NH3中N原子的杂化类型为_____,1mol 配离子[Cu(NH3)2]+中含有σ键的数目为______。
③写出与CO 互为等电子体的一种离子的化学式__________________。
(3)金属铼的熔点高于锰,试从原子结构的角度加以解释_________________________________________________。
(4)三氧化铼为立方晶胞,晶胞参数为3.74A(1A=10-10m),铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为_______,三氧化铼的密度为____g/cm3。(用NA表示阿伏加德罗常数的值,写计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.放热过程均发生化学反应
B.周期表中第13列元素均为金属元素
C.在过渡元素中可寻找催化剂和耐高温、耐腐蚀的合金材料
D.合成氨反应达到平衡时,正、逆反应速率相等且均为0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com