
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。
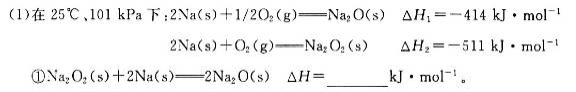
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,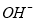 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为:
 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 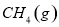 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。

①0~10 min内用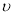 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.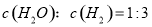
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
(18分)
(1)①—317(2分)②3.01×1025或0.5NA(2分)
(2)①负(2分)②2H2O+2e?=2OH?+H2↑(2分)③降低LiCl的熔点(2分);2Cl?-2e?=Cl2↑(2分)
(3)①0.1mol?L-1?min-1(2分)②b(2分)③13.5(2分)
【解析】
试题分析:(1)①根据盖斯定律,?H=2?H1—?H2=—317kJ?mol?1
②Na在足量O2中充分燃烧,生成Na2O2,参加反应的O2体积为5.6 L(标准状况),物质的量为0.25mol,则该反应过程中转移电子的物质的量为0.5mol,则数目为3.01×1025或0.5NA。
(2)①原电池内部电解质溶液中阳离子向正极移动,阴离子向阴极移动,所以OH?向阴极移动。
②以LiOH为电解质,加入水即可放电,所以电池放电时正极反应为:2H2O+2e?=2OH?+H2↑
③电解时LiCl为熔融态,电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li,所以熔盐混合物中KCl的作用是降低LiCl的熔点;阳极Cl?失电子生成Cl2,电极方程式为:2Cl?-2e?=Cl2↑
(3)①v(CO)=v(CH4)=(4mol-2mol)÷2L÷10min=0.1mol?L-1?min-1。
②a、生成3 molH-H键,说明生成了3mol H2,同时有4 molC-H键断裂,说明1mol CH4反应,都是正反应,错误;b、反应容器恒容,反应前后气体系数不相等,其他条件不变时,反应体系的压强保持不变,证明该反应已达到平衡状态,正确;c、反应物均为气体,根据质量守恒定律,不论反应是否平衡,气体的质量不变,错误;d、H2O与H2的浓度之比与反应是否平衡无关,错误。
③根据图像可得平衡时,c(CO)=1mol?L?1,c(H2)=3mol?L?1,c(CH4)=1mol?L?1,c(H2O)=2mol?L?1,则平衡常数K=33×1÷(1×2)mo12·L-2=13.5mo12·L-2。
考点:本题考查盖斯定律、氧化还原反应原理、原电池与电解池原理、反应速率、化学平衡的判断及计算。


科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:填空题
(8分)下列物质中互为同分异构体的有 ,互为同素异形体的有 ,属于同位素的有 ,属于同一种物质的有 。(填序号)
①液氯 ②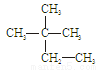 ③白磷 ④18O ⑤
③白磷 ④18O ⑤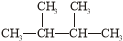
⑥红磷 ⑦16O ⑧氯气
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:选择题
下列物质中,物质的水溶液能导且该物质属于非电解质,溶于水时化学键被破坏的是( )
A.氯化氢 B.蔗糖 C.干冰 D.硫酸钡
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二5月月考化学试卷(解析版) 题型:选择题
下列关于醇和酚的说法中,正确的是( )
A.含有羟基的化合物一定是醇
B.分子内有苯环和羟基的化合物一定是酚
C.羟基跟链烃基相连时,有机物为醇
D.酚和醇具有相同的官能团,因而具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:推断题
(12分)【化学——有机化学基础】
饱受争议的PX项目是以苯的同系物F为原料的化工项目。F中苯环上的取代基是对位关系。用质谱法测得F的相对分子质量为106,A的相对分子质量为92,A与F属于同系物。下图是以A、F为原料制得J的合成路线图。
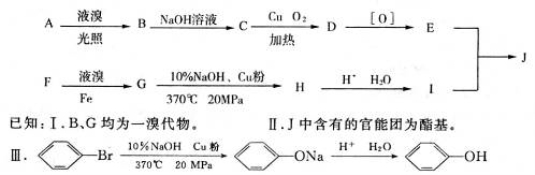
(1)写出F的结构简式:______________。
(2)C所含官能团的名称是____________。
(3)C→D的反应类型属于_____________;F→G的反应类型属于____________。
(4)写出满足以下三个条件的I的同分异构体的结构简式:______________。
i属于芳香族化合物 ii不与金属钠发生化学反应iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2。
(5)写出E和I反应最终生成J的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:选择题
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是

A.Y元素气态氢化物的稳定性大于Z元素的
B.M和Y两种元素,可以形成电子层结构相同的两种简单离子
C.X元素最高价氧化物对应水化物的酸性弱于Y元素的
D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:实验题
(15分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下。
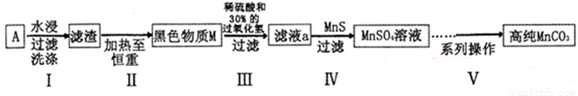
(1)碱性锌锰干电池的负极材料是 (填化学式)。
(2) 第I步操作得滤渣的成分是 ;第Ⅱ步操作的目的是 。
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为 。
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为 。
(已知:Ksp(MnS)=2.5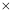 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6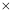 10-24)
10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,l00oC时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7; 操作2:过滤,用少量水洗涤2~3次;
操作3:检测滤液; 操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①试剂X是 ;
②操作3中,说明SO42-已除干净的方法是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
将0.1mol两种气态烃组成的混合气体完全燃烧后得3.36L(标准状况)CO2和3.6gH2O下列说法正确的是
A.一定有乙烯 B.一定有甲烷 C.可能有丙烯 D.可能有乙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com