
| A. | 离子反应中一定有沉淀生成 | |
| B. | 反应中有气体生成的反应一定是离子反应 | |
| C. | 复分解型离子反应是一定有沉淀、气体和水生成的反应 | |
| D. | Fe2O3与稀硫酸的反应一定属于离子反应 |
分析 在溶液中离子反应发生的条件是生成难溶性的或难电离的或易挥发的物质,复分解型离子反应不存在化合价的变化,如有沉淀、气体和水生成,则可发生复分解反应,以此解答该题.
解答 解:A.在溶液中离子反应发生的条件是生成难溶性的或难电离的或易挥发的物质,不一定有沉淀生成,故A错误;
B.有气体生成的反应不一定是离子反应,Zn和稀盐酸反应生成氢气,故C错误;
C.复分解反应的条件为有沉淀、气体和水生成,但前提是没有发生氧化还原反应反应,故C错误;
D.Fe2O3与稀硫酸反应生成了H2O,属于离子反应,故D正确.
故选D.
点评 本题考查离子反应,侧重于化学反应原理和规律的考查,注意把握离子反应的特点和实质,能结合实例解答该题,题目难度不大,注意相关基础知识的积累.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
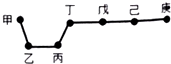
| A. | 单质甲与单质乙充分反应一定都可以生成多种化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊>丁 | |
| C. | 可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质 | |
| D. | 因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
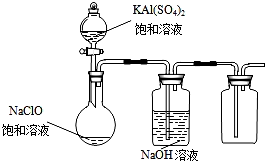 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
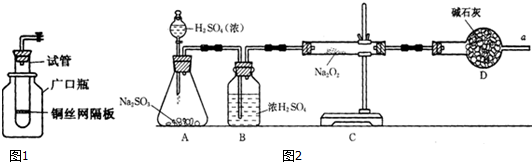
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
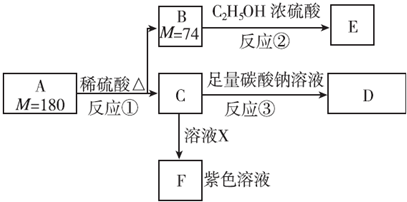
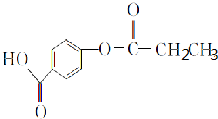 ,1 mol A与足量NaOH溶液反应的化学方程式为
,1 mol A与足量NaOH溶液反应的化学方程式为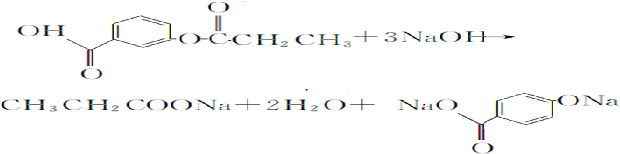 .
.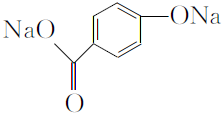 .
. 和
和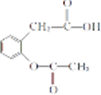 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
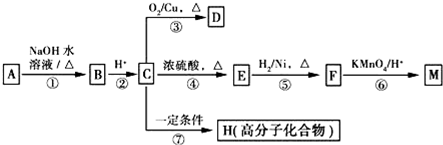
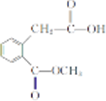
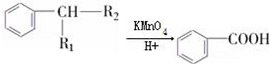 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)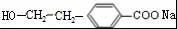 .
.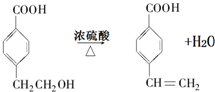 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2 L乙醇蒸气含共价键数目为4NA | |
| C. | 1mol K与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L 0.2 mol•L-1 NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
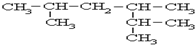
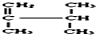 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;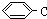 ≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个. 表示的分子式C6H14.
表示的分子式C6H14.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com