
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
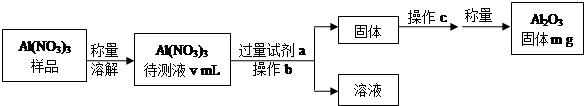
分析 样品称量溶解得到待测溶液,加入过量一水合氨溶液,Al(NO3)3和氨水反应生成Al(OH)3,经过滤、洗涤、灼烧后生成Al2O3,根据Al2O3的质量可确定的Al(NO3)3待测液中,c(Al3+),
(1)由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,经过滤、洗涤、灼烧后生成Al2O3,根据Al2O3的质量可确定的Al(NO3)3待测液中,c(Al3+);
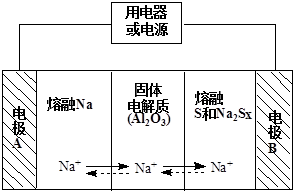
(2)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答.
解答 解:(1)①由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,试剂a为氨水,反应的方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
②Al(OH)3经过滤、洗涤、灼烧后生成Al2O3,冷却后称量,
故答案为:过滤;洗涤、灼烧(或加热)、冷却;
③n(Al2O3)=$\frac{mg}{102g/mol}$=$\frac{m}{102}$mol,
则n(Al(NO3)3)=2n(Al2O3)=$\frac{m}{51}$mol,
c(Al(NO3)3)=$\frac{\frac{m}{51}mol}{v×1{0}^{-3}L}$=$\frac{1000m}{51v}$mol/L,
故答案为:$\frac{1000m}{51v}$;
(2)①原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有c符合,
故答案为:c;
②放电时,Na被氧化,应为原电池负极,故答案为:负;
③阳离子向正极移动,即从A到B,故答案为:从A到B;
④充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-═xS.
点评 本题考查较为综合,涉及物质的分离、提纯以及含量的测定和原电池知识,侧重于学生的分析能力、实验能力、计算能力的考查,为高频考点,注意相关基础知识的积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
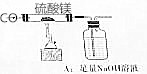 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯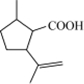 .
.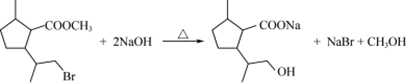 .
.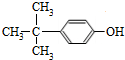 .
. 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路查看答案和解析>>
科目:高中化学 来源: 题型:推断题
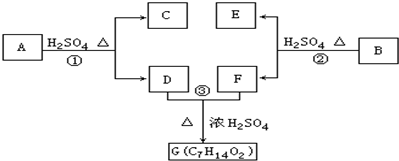
 ;
;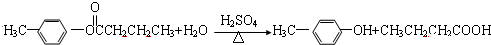 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).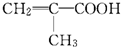 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$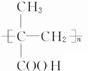 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com