
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)依据溶液中电荷守恒计算;
(2)①高温会引发N2和O2反应生成一氧化氮;
②氮氧化物形成酸雨是硝酸型酸雨,二氧化氮和水反应生成硝酸和一氧化氮;
(3)①钙基固硫法:CaO+SO2+O2=CaSO4;
②二氧化硫是酸性氧化物,氢氧化钠溶液可以吸收,生成亚硫酸氢钠或亚硫酸钠,二氧化硫被氧气催化氧化生成三氧化硫.
解答 解:(1)溶液中存在电荷守恒c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)结合图表数据计算得到氢离子浓度c(H+)=1×10-4 mol/L,
故答案为:1×10-4 ;
(2)①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;高温\;}}{\;}$2NO;
②NOx能形成酸雨,由NO2形成的酸雨为硝酸型酸雨,硝酸溶液中含有的主要离子有H+、NO3-,反应的离子方程式为;3NO2+H2O═2H++2NO3-+NO,
故答案为:3NO2+H2O═2H++2NO3-+NO;
(3)①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,是氧化钙和二氧化硫反应生成亚硫酸钙,亚硫酸钙被氧气杨宏伟硫酸钙,CaO+SO2+O2=CaSO4,最高价态的化合物为CaSO4,
故答案为:CaSO4;
②二氧化硫是酸性氧化物,
a、氢氧化钠溶液可以吸收二氧化硫,生成亚硫酸氢钠或亚硫酸钠,故a正确;
b、硫酸不能吸收二氧化硫,故b错误;
c、NaHSO3不能吸收二氧化硫,故c错误;
故选a;
硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,
故答案为:a;2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3.
点评 本题考查了二氧化硫性质、氮氧化物性质的分析应用,钙基固硫原理的理解分析,掌握基础注意积累知识是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$ Cl2(气)═HCl(气)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
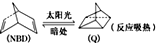 ,下列叙述中错误的是( )
,下列叙述中错误的是( )| A. | Q的能量高于NBD | B. | NBD和Q的分子式不同 | ||
| C. | Q的一氯代物只有3种 | D. | NBD的同分异构体可以是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 燃烧反应必须有氧气作氧化剂 | |
| C. | 2Fe+3Cl2═2FeCl3; Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS 由此可以判断氧化性:Cl2>S | |
| D. | Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气法处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减 少资源消耗、增加资源的重复使用、奖励资源的循环再生使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com