
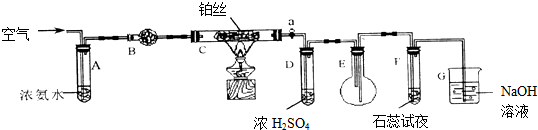
 ijУ��ѧ�о���ѧϰС����Ũ������������̼��ȷ�Ӧ����ȡ���ռ�������װ����ͼ��
ijУ��ѧ�о���ѧϰС����Ũ������������̼��ȷ�Ӧ����ȡ���ռ�������װ����ͼ������ ��1���跨ʹװ�������γ���ѹ���������Լ��ij����ֶΣ�ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ���������������ݵ����ɡ�ˮ�����γɡ�Һ��������ȣ����ж�װ�������Եĺû���
��2�����ݷ���ʽMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O������ת�Ƶ�������
��3�������е�ߣ���Һ����
��� �⣺��1��װ�������Եļ�飺���Ӻ�װ�ú��õ��ɼм�סB���ɷ����ϵ�����Һ©���м�ˮ��������©���е�Һ��߶Ȳ��䣬˵�����������ã��ʴ�Ϊ��B��Һ�棨ˮ�棩���½���
�ʴ�Ϊ��B�� Һ��߶Ȳ��ٱ仯��
��2�����ݷ���ʽMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O������4mol�Ȼ�������1mol������ת��2mol���ӣ��ʴ�Ϊ��2��
��3��ʵ������п�������ƿ���л���ɫҺ�Σ�˵���������е���������Һ�����ʴ�Ϊ����Һ����
���� ���⿼��ʵ������ȡ����������Ϊ��Ƶ���㣬��ȷʵ��ԭ���ǽⱾ��ؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ý�������ȡ����Ӧ��ȡ���� | |
| B�� | ������ȩ��ͬ���칹�� | |
| C�� | ������ϩͨ���ӳɷ�Ӧ��ȡ | |
| D�� | ͨ��ȡ����Ӧ����ȡ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������أ�̨�ݸ������� | B�� | ̫������ˮ������ȼ����ˮ�� | ||
| C�� | �ž�ʹ��һ��ȼ�� | D�� | ����������һ�������ϴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������̺���Ԫ����80���֣����е�Ĵ����ɴ�8��1010t�����Եⱻ��Ϊ����Ԫ�� | |
| B�� | 1774������ѧ����������ط���һ�ֻ���ɫ���壬����������Ϊ���� | |
| C�� | 19���Ϳ�ѧ�Ҵ�ά�״��õ���Ȼ�����Һ�ķ����Ƶý����� | |
| D�� | �ƺͼصĺϽ�������Һ�壬�����ڿ����ӷ�Ӧ�ѵĵ��ȼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4Cl+NaOH $\frac{\underline{\;\;��\;\;}}{\;}$ NaCl+H2O+NH3�� | |
| B�� | Fe+CuSO4�TCu+FeSO4 | |
| C�� | CH4+2O2$\frac{\underline{\;\;��\;\;}}{\;}$CO2+2H2O | |
| D�� | 2KMnO4 $\frac{\underline{\;\;��\;\;}}{\;}$ K2MnO4+MnO2+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com