
 Fe2++Ag+,FeCl3和金属银反应生成的是氯化银和氯化亚铁,而硫酸铁和金属银反应生成的是硫酸银,因为AgCl溶解度比Ag2SO4小,所以加入FeCl3溶液更有利,
Fe2++Ag+,FeCl3和金属银反应生成的是氯化银和氯化亚铁,而硫酸铁和金属银反应生成的是硫酸银,因为AgCl溶解度比Ag2SO4小,所以加入FeCl3溶液更有利,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
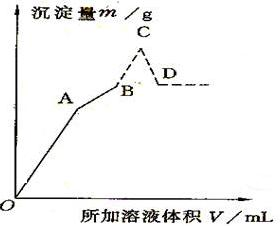
| A | B | C | D | |
| V[Ba(OH)2 (aq)]/ml | ||||
| V[HCl(aq)]/ml | ||||
| M沉淀/g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知,现使用1 mol/L KI溶液、0.1 mol/L硫酸和淀粉溶液探究溶液出现蓝色的时间与温度的关系,应先将1 mol/L KI溶液、0.1 mol/L硫酸混合,升温后再加入淀粉溶液 |
| B、将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是浓硫氰化钾溶液,红色都会加深 |
| C、向0.1 mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成 |
| D、实验测定酸碱滴定曲线时.要保证整个过程测试和记录pH的间隔相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中加入等物质的量的Ba(OH)2溶液Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、向Fe2(SO4)3溶液中通入足量的H2S:Fe3++H2S=Fe2++S↓+2H+ |
| C、向硝酸银溶液中滴加过量氨水:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、含等物质的量的硫酸氢铵与氢氧化钠两种溶液混合:NH4++HSO4-+2OH-=SO42-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42-和NO3-可能来自同一工厂 |
| B、Cl-和NO3-一定在相同的工厂 |
| C、Ag+和Na+可能来自同一工厂 |
| D、Na+和NO3-一定来自不同的工厂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、羊毛与聚酯纤维的化学成分相同 |
| B、聚酯纤维和羊毛在一定条件下均能水解 |
| C、聚酯纤维与羊毛均为天然有机高分子化合物 |
| D、聚酯纤维属于纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com