
分析 稀有气体原子最外层为稳定性结构,化学性质最不活泼;
同周期自左而右元素金属性减弱、非金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价氧化物对应水化物的酸性越强;氢氧化铝能与酸、碱反应生成盐与水,属于两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水.
解答 解:稀有气体Ar原子最外层为稳定性结构,化学性质最不活泼;
同周期自左而右元素金属性减弱、非金属性增强,故第三周期中Na金属性最强、Cl的非金属性最强,而金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价氧化物对应水化物的酸性越强,故NaOH碱性最强,HClO4的酸性最强,Al(OH)3能与酸、碱反应生成盐与水,属于两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH?=AlO2-+2H2O,
故答案为:Ar;HClO4;NaOH;Al(OH)3;Al(OH)3+OH?=AlO2-+2H2O.
点评 本题考查元素周期律的应用,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | m+n>p+q 正反应是放热反应 | B. | m+n>p+q 正反应是吸热反应 | ||
| C. | m+n<p+q 逆反应是放热反应 | D. | m+n=p+q 逆反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中学实验室用如图装置制取少量溴苯,在烧瓶a中装的试剂是苯、液溴和铁粉,d中装的是蒸馏水.请回答下列问题.
中学实验室用如图装置制取少量溴苯,在烧瓶a中装的试剂是苯、液溴和铁粉,d中装的是蒸馏水.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释后溶液中的c(H+)和c(OH-)均减小 | |
| B. | 稀释过程中氨水的电离平衡向左移动 | |
| C. | 稀释后溶液中c(OH-)变为稀释前的$\frac{1}{10}$ | |
| D. | 稀释过程中溶液中$\frac{[0{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be的原子半径小于B 的原子半径 | |
| B. | Be比Na金属性强 | |
| C. | Be的最高价氧化物对应水化物碱性弱于Ca(OH)2 | |
| D. | Be能跟冷水反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
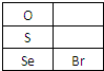
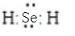 .
.| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | SeO2+2SO2+2H2O═Se+2H2SO4 |
| 2 | 还原性 | SeO2+2H2O2=H2SeO4+2H2O |
| 3 | 酸性氧化物 | SeO2+NaOH=Na2SeO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | CO | C. | CO2 | D. | NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com