

| n(CH3OH) |
| n(CO2) |
| 生成物浓度的系数幂次方 |
| 反应物浓度的系数幂次方 |
| 反应物浓度系数的幂次方 |
| 反应物浓度的系数幂次方 |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |


科目:高中化学 来源: 题型:
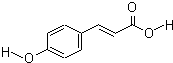 对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:
对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7、K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C、Z元素形成的某种单质有漂白性 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 |
| B、已知Si3N4、Al2O3熔点很高,一般可以用制作高温结构陶瓷制品 |
| C、乙烯能使溴水褪色、聚乙烯不能使溴水褪色 |
| D、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行焰色反应时,必须用稀盐酸洗涤并灼烧铂丝,然后再进行实验 |
| B、分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| C、读取滴定管内液体体积时,俯视读数导致读数偏大 |
| D、纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com