
【题目】短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是( )
A. 原子半径A<B<C
B. A的氢化物的稳定性小于C的氢化物的稳定性
C. C的氧化物的熔点比A的氧化物的低
D. A与C可形成原子晶体
【答案】D
【解析】
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则A原子只能有2个电子层,B原子最外层电子数为2,A、C原子最外层电子数=![]() =4,故A为碳元素、C为Si,结合原子序数可知,B为Mg元素,据此解答。
=4,故A为碳元素、C为Si,结合原子序数可知,B为Mg元素,据此解答。
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径C<Si<Mg,故A错误;
B.A为C元素、C为Si,非金属性C>Si,故A的氢化物稳定性大于C的氢化物稳定性,故B错误;
C.二氧化硅为原子晶体,二氧化碳为分子晶体,二氧化硅的熔点比二氧化碳高,故C错误;
D.Si与C形成SiC为原子晶体,故D正确。
故选D。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子结构中,各种化学键如下图所示:关于乙醇在各种反应中断裂键的说明正确的是( )

A. 和乙酸、浓H2SO4共热时断裂键②
B. 和金属钠反应时断裂键⑤
C. 和浓H2SO4共热至170℃时断裂②、⑤键
D. 在Cu催化下和O2反应时断裂①、⑤键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量氢氧化钠溶液:![]() +OH-=
+OH-=![]() +H2O
+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:

(1)A的化学名称是_____________,C中含氧官能团的名称为_____________。
(2)F的结构简式为____________________,A和E生成F的反应类型为______________。
(3)A生成B的化学方程式为__________________________________________________。
(4)写出由C合成D的第二个反应的化学方程式:_________________________________。
(5)同时满足下列条件的E的同分异构体有_________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式 ____________ 。焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了 _________ 而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式

请分析1个松脂酸铜中π键的个数_____ ;加 “*”碳原子的杂化方式为 ______ 。
(3)下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)______________ ;与X等距离且最近的X原子个数为____

(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型______,比较第一电离能:S _____ O(填“>”或“<”)
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果)____________ nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了Cu—Ni—Zn—Sn—Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)
(2)基态Ni2+的核外电子排布式为________;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO______FeO(填“<”或“>”),其原因是_________________________________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol (SCN)2分子中含有σ键的数目为________;写出一种与SCN-互为等电子体的分子________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。

(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为a pm,列式表示NiO晶体的密度为________g·cm-3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J (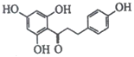 )是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
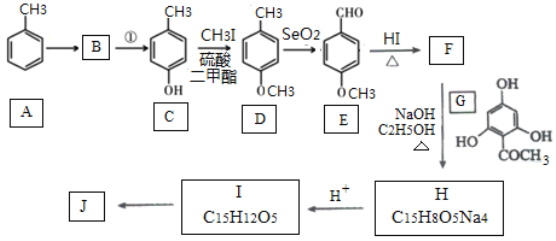
已知:
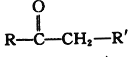 +R"CHO
+R"CHO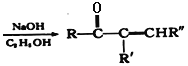 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应试剂___________.
(3)写出由C生成D的反应类型___________
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应
②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
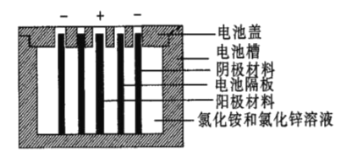
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com