
| A. | 原子序数 | B. | 元素性质 | C. | 原子半径 | D. | 化合价 |
分析 随着原子序数的递增,核外电子排布、元素的化合价、原子半径、金属性和非金属性呈现周期性变化,以此解答该题.
解答 解:周期表中,同周期元素原子核外电子层数相同,从左到右最外层电子数逐渐增多,同主族元素最外层电子数相同,从上到下电子层数逐渐增多,而元素的性质、化合价与最外层电子数有关,原子半径与电子层数有关,则核外电子排布、元素的化合价、原子半径、金属性和非金属性呈现周期性变化,而原子序数无周期性变化规律.
故选A.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,侧重考查学生的分析能力,要理解元素性质呈周期性变化的原因是元素原子的核外电子排布的周期性变化的结果,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
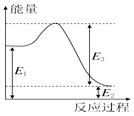 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| B. | 在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变 | |
| C. | 已知Ksp(AgCl)>Ksp(AgI),则反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 | |
| D. | 在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
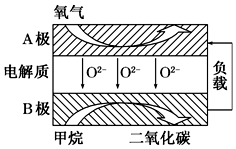 以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.下列说法错误的是( )
以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.下列说法错误的是( )| A. | 以甲烷为燃料,其成本大大低于以氢气为燃料的传统燃料电池 | |
| B. | A电极为电池正极,发生还原反应 | |
| C. | B电极反应式为CH4+4O2--8e-═CO2+2H2O | |
| D. | 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol•L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为22.4L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI被氧化成KOH | |
| B. | KI是离子化合物,I2是共价化合物 | |
| C. | 1 mol O3 在反应中得到4 mol 电子 | |
| D. | KOH中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com