
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
分析 A.煤是多种有机物和无机物的混合物;
B.化学燃料是不可再生的;
C.化学反应都伴随着能量的变化;
D.根据旧键断裂吸收能量和新键生成释放能量角度来判断反应的吸放热情况.
解答 解:A.煤是多种有机物和无机物的混合物,主要成分是碳单质,不是化合物,故A错误;
B.化学燃料是不可再生的,且不廉价,故B错误;
C.化学电源放电、植物光合作用都伴随着能量的变化,故C正确;
D.从化学键角度判断反应是吸热还是放热的方法:旧键断裂吸收能量大于新键生成释放能量,反应是吸热反应,反之是放热反应,故D错误.
故选C.
点评 本题考查化学反应中能量变化的原因,注意从化学键角度和物质具有的能量角度来回答,难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
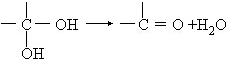
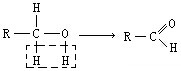
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
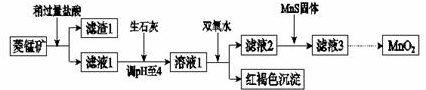
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯属于高级脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纤维素的物质可以制造酒精 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+CO2=HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gD2O与2gH218O含有的中子数均为NA | |
| B. | 1L0.1mol•L-1Na2S溶液中S2-和H2S的数目之和为0.1NA | |
| C. | 漂白粉中加入浓盐酸,每生成1molCl2,转移的电子数2NA | |
| D. | 常温下,将1molNO2气体加压生成N2O4的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com