
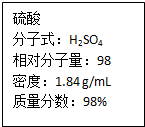
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| 0.1mol/L×0.5L |
| 18.4mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
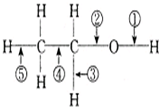 乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )
乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )| 反应 | 反应类型 | 断键位置 | |
| A | 乙醇与金属钠 | 置换 | ① |
| B | 乙醇/浓硫酸170℃ | 消去 | ②⑤ |
| C | 乙醇/浓氢溴酸加热 | 取代 | ① |
| 乙醇与乙酸/浓硫酸加热 | 酯化 | ① | |
| D | 乙醇/Cu Ag加热 | 催化氧化 | ①③ |
| 燃烧 | 氧化 | ①②③④⑤ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、复合材料保持了原材料的优点,又有优于原材料的特点 |
| B、玻璃钢是一种新型合金材料,其强度和韧性都强于钢铁 |
| C、“神六”飞船使用了大量的复合材料 |
| D、铜是一种有色金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
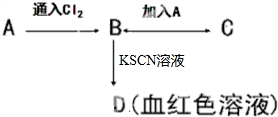 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验装置 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
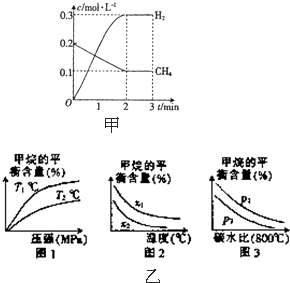 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.| t/min | n(CH4)/mol | n(H20)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com