
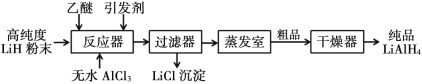
【题目】氢化铝锂(LiAlH4)以其优良的还原性能在医药、香料、农药、染料等行业中广泛应用。纯氢化铝锂是一种白色晶状固体,熔点 125℃,加热至 130℃时分解,溶于醚、四氢呋喃,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。目前世界上有四种工业生产 LiAlH4的方法,其中施莱兴格(Schlesinger)法和高压合成法最为常见。
Ⅰ. 施莱兴格(Schlesinger)法
Ⅱ.高压合成法
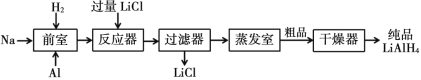
请根据题中信息回答以下问题:
(1)Schlesinger 中的反应器需要附加电磁搅拌器,目的是________。
(2)Schlesinger 的反应器中发生的化学反应方程式是________。
(3)采用 Schlesinger 时需要使用大量高纯度氩气,氩气的作用是________。
(4)为了降低成本,在 Schlesinger 工艺中有一种原料可以循环使用,这种原料是________。
(5)已知乙醚沸点为 35℃,某工厂准备在蒸发室采用减压蒸发分离出产品,你认为有无必要,请简述理由________。
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有________。
(7)使用氢化铝锂要注意安全, 少量未反应完的需要分解处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全。请写出此过程的化学反应方程式______________________________________。
【答案】加快反应速率,使反应更充分 4LiH+AlCl3=LiAlH4+3LiCl 保护气,排出设备中的空气和水蒸气 乙醚 无必要,乙醚沸点远低于LiAlH4的分解温度,直接加热蒸发即可分离 烧杯、漏斗、玻璃棒 LiAlH4+4HCl=LiCl+AlCl3+4H2↑
【解析】
纯氢化铝锂的熔点 125℃,加热至 130℃时分解,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。根据施莱兴格(Schlesinger)法和高压合成法生产LiAlH4的流程,结合化学实验的基本操作和方法分析解答。
(1)Schlesinger 中的反应器中附加电磁搅拌器,可以增大反应物的接触面积,加快反应速率,使反应更充分,故答案为:加快反应速率,使反应更充分;
(2)根据流程图,Schlesinger 的反应器中高纯度LiH粉末和无水AlCl3反应生成LiAlH4和LiCl,反应的化学反应方程式为4LiH+AlCl3=LiAlH4+3LiCl,故答案为:4LiH+AlCl3=LiAlH4+3LiCl;
(3) 纯氢化铝锂在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应,采用 Schlesinger 时需要使用大量高纯度氩气,氩气性质稳定,可以用作保护气,排出设备中的空气和水蒸气,防止氢化铝锂遇水爆炸,故答案为:保护气,排出设备中的空气和水蒸气;
(4)根据流程图,蒸发室中蒸发出来的物质中含有乙醚,为了降低成本,在 Schlesinger 工艺中乙醚可以循环使用,故答案为:乙醚;
(5)乙醚沸点为 35℃,远低于LiAlH4的分解温度(130℃),因此在蒸发室没有必要采用减压蒸发,故答案为:无必要,乙醚沸点远低于LiAlH4的分解温度,直接加热蒸发即可分离;
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(7) 氢化铝锂加热至 130℃时分解,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应,使用氢化铝锂要注意安全,少量未反应完的氢化铝锂需要及时处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全,氢化铝锂与盐酸反应放出氢气,反应的化学反应方程式为LiAlH4+4HCl=LiCl+AlCl3+4H2↑,故答案为:LiAlH4+4HCl=LiCl+AlCl3+4H2↑。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.乙醇、乙二醇、丙三醇互为同系物
B.1mol甲基![]() 所含的电子数约为10×6.02×
所含的电子数约为10×6.02×![]()
C.14g分子式为![]() 的链烃中含有的C=C的数目一定为
的链烃中含有的C=C的数目一定为![]()
D.同分异构体间具有完全相同的物理性质和化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110 ℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:
Ⅰ.草酸合铁酸钾晶体的制备
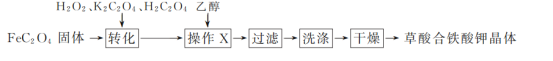
(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:_________________________。
(2)“操作X”中加入乙醇的目的是_______________________。
Ⅱ. 草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量________(填“偏大”“偏小”或“不变”)。
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。 ________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
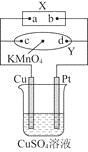
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH先减小,后增大
D.烧杯溶液中SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质 的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液(已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
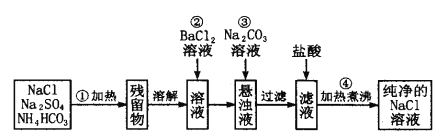
如果此方案正确,那么:
(1)操作①可选择_______ 或__________(仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是___________。
(3)进行操作②后,如何判断SO42-已除尽的方法是__________ 。
(4)操作③的目的是________,写出此操作涉及的离子方程式:___________
(5)操作④的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 和 CH4 重整可制备合成气,催化重整反应历程示意图如下:
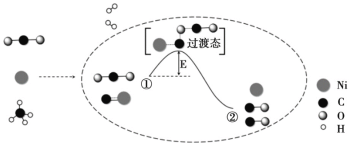
下列说法不正确的是
A.Ni 在该反应中做催化剂,参与化学反应
B.①→②吸收能量
C.①→②既有碳氧键的断裂,又有碳氧键的形成
D.合成气的主要成分为 CO 和 H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素参与组成的新型材料有着广泛的用途,回答下列问题。
(1)基态铁原子核外共有________种不同空间运动状态的电子。铁、钴、镍基态原子中,核外未成对电子数最少的原子价层电子轨道表示式(电子排布图)为________。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO________FeO(填“>”“<”或“=”),原因是________。
(3)Cr的一种配合物结构如图所示:
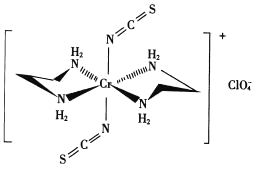
①阴离子![]() 的空间构型为________形。
的空间构型为________形。
②配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为_______键。
③配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为________。
(4)一种新型材料的晶胞结构如图1所示,图2是晶胞中Sm和As原子的投影位置。
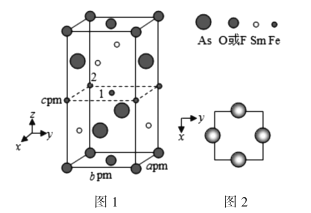
图1中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为________,晶体密度ρ=________g·cm3(用含x的表达式表示,设阿伏加德罗常数的值为NA)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标(![]() ),则原子2的坐标为________。
),则原子2的坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
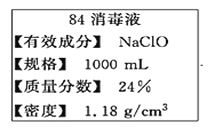
(1)NaClO中氯元素的化合价为________
(2)量取100mL此液,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=______mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。用如图所示的仪器中配制溶液,还缺少的玻璃仪器是_____________。
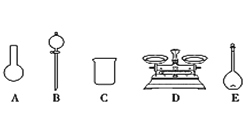
(4)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入固体再加水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(5)下面操作造成所配84消毒液浓度偏高的是___________(填序号)。
A.没有冷却到室温就转移并快速定容
B.转移时没有洗涤烧杯、玻璃棒
C.定容时俯视液面
D.称量时托盘天平“左码右物”
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com