
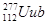 的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的原子。下列说法中正确的是( )
的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的原子。下列说法中正确的是( )A.每次衰变都放出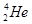 |
| B.每次衰变都放出T |
C.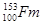 只是元素镄的一个原子,153不代表镄元素的相对原子质量 只是元素镄的一个原子,153不代表镄元素的相对原子质量 |
D.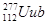 经过3次这样的衰变是得不到镄原子的,产生的是Uub的同位素原子 经过3次这样的衰变是得不到镄原子的,产生的是Uub的同位素原子 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.X的气态氢化物比Y的稳定 | B.X与Y形成的化合物都易溶于水 |
| C.Z的非金属性比Y的弱 | D.原子半径:X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④ | C.②④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镁原子由基态转化成激发态,这一过程中吸收能量 |
| B.镁原子由激发态转化成基态,这一过程中释放能量 |
| C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同 |
| D.转化后镁原子与硅原子电子层结构相同,化学性质相似 |
查看答案和解析>>
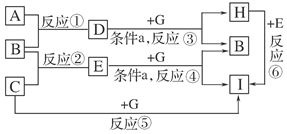
科目:高中化学 来源:不详 题型:实验题
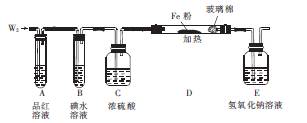
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)W的第一电离能比氧原子的 (填“大”或“小”),W的气态氢化物稳定性比
(1)W的第一电离能比氧原子的 (填“大”或“小”),W的气态氢化物稳定性比 H2O(g) (填“强”或“弱”),W的单质分子中含 个∏键;
H2O(g) (填“强”或“弱”),W的单质分子中含 个∏键; (2)Z位于元素周期表第 周期第 族,Z的基态原子核外电子排布式是 ;
(2)Z位于元素周期表第 周期第 族,Z的基态原子核外电子排布式是 ; (3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| R | 元素所处的周期数、主族序数、原子序数均相等 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | 元素最高正价+7价 |
| Y | 第三周期金属元素中原子半径最小 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
 种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的
种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的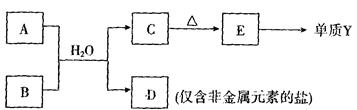
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com