
| A�� | �÷�Ӧ��������Ҫȡ���ڢٵĿ��� | |
| B�� | NOBr2�Ǹ÷�Ӧ�Ĵ��� | |
| C�� | ����Ӧ�Ļ�ܱ��淴Ӧ�Ļ��Сa kJ•mol-1 | |
| D�� | ����Br2��g��Ũ�����������Ӱٷ������ӿ췴Ӧ���� |
���� A����Ӧ������Ҫȡ��������һ����
B��NOBr2�����
C������Ӧ���ȣ����ѻ�ѧ�����յ�����С���γɻ�ѧ���ų���������
D������Ũ�ȣ�����Ӱٷ������䣮
��� �⣺A����Ӧ������Ҫȡ��������һ�������Է�Ӧ������Ҫȡ���ڢڵĿ�������A����
B��NOBr2���м��������Ǵ�������B����
C������Ӧ���ȣ����ѻ�ѧ�����յ�����С���γɻ�ѧ���ų���������������Ӧ�Ļ�ܱ��淴Ӧ�Ļ��Сa kJ•mol-1����C��ȷ��
D������Ũ�ȣ�����Ӱٷ������䣬��D����
��ѡC��
���� ���⿼���˷�Ӧ�ʱ�ĺ���ͼ��㡢�����ȣ�������ѧ���ķ��������Ŀ��飬ע�����1����2�����ȣ��ܷ�Ӧ������Ϊ���ȷ�Ӧ���ѶȲ���


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
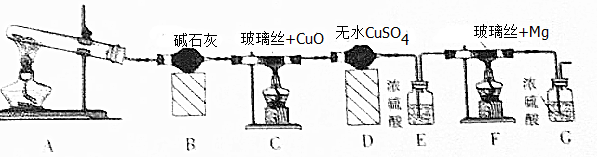
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ�ⳣ������ | B�� | n��O2������ | ||
| C�� | SO2������������� | D�� | c��SO2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N | B�� | O | C�� | S | D�� | Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ������ˮʱʹˮ�������������� | |
| B�� | �峿�����еĵ������� | |
| C�� | �����������ֵ��ܿ������ԵĹ��� | |
| D�� | ����ʯ��ˮ��ͨ��CO2���壬�а�ɫ�ij��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
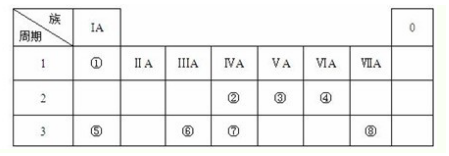
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʾ���ȼ���ȵ��Ȼ�ѧ����ʽS��s��+$\frac{3}{2}$O2��g��=SO3��g������H=-315 kJ/mol | |
| B�� | ��ʾ�к��ȵ��Ȼ�ѧ����ʽNaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l������H=-57.3 kJ/mol | |
| C�� | ��ʾH2ȼ���ȵ��Ȼ�ѧ����ʽH2��g��+$\frac{1}{2}$O2��g��=H2O��g������H=-241.8 kJ/mol | |
| D�� | ��ʾCOȼ���ȵ��Ȼ�ѧ����ʽ2CO��g��+O2��g��=2CO2��g������H=-566 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1�� | B�� | 2�� | C�� | 3�� | D�� | 4�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com