
【题目】下列各组比较中正确的是
A. 熔点:Li<Na<K
B. 稳定性:CH4<NH3<H2O<HF
C. 酸性:HClO4<H2SO4<H3PO4
D. 还原性:Br-<Cl-<S2-
科目:高中化学 来源: 题型:
【题目】向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定金属镁的相对原子质量,请利用如图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。

填写下列各项(气流从左到右):
(1)各种仪器连接的先后顺序是___接___、___接___、___接___、_____接___(用小写字母表示)。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是____(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为V0 mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为w g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水V1mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为____。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据____(填“偏大”“偏小”或“无影响”)。
(5)仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如图所示的实验装置。
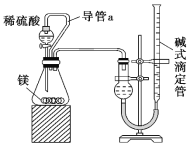
装置中导管a的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A. 离子化合物中不可能含有共价键 B. 晶体中一定存在化学键
C. 碱性氧化物一定是金属氧化物 D. 直径介于1~10 nm之间的微粒称为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用CCl4从溶有碘的氯化钠溶液中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL混合溶液和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检查分液漏斗活塞和上口的玻璃塞是否漏夜;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置,分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写)____
![]()
![]()
![]() A
A![]() G
G![]() E
E![]() F。
F。
(2)上述E步骤的操作中应注意___;上述G步骤操作的目的是____。
(3)已知碘在酒精中的溶解度比在水中的大得多,能不能用酒精来萃取碘水中的碘___(填“能”或“不能”),其理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
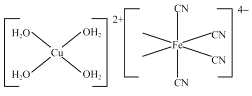
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。
(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。工业上常用钒炉渣(主要含FeOV2O3,还有少量SiO2、P2O5等杂质)提取V2O5的流程如图:

(1)焙烧的目的是将FeOV2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价,写出该反应的化学方程式 _________________________________
(2)加MgSO4溶液的步骤中,滤渣的主要成分是_____________(用化学式表示)。
(3)沉钒过程中的发生反应的离子方程式为_________________,得到的固体物质往往需要洗涤,写出实验室洗涤NH4VO3沉淀的操作方法_______________。
(4)元素钒在溶液中还可以 以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)等形式存在.某利用钒元素微粒间的反应来设计的可充电电池的工作原理如图示,已知溶液中还含有1 mol 硫酸,请回答下列问题:

①充电时,左槽电极上发生的电极反应式为________________
②放电过程中,右槽溶液颜色变化为_______________________,若此时外电路转移了3.01×1022个电子,则左槽溶液中H+的变化量Δn(H+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是

A. 若R为甲基则该物质的分子式可以表示为C16H10O7
B. 分子中有三个苯环
C. lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol
D. 1mol该物质与足量溴水反应耗6molBr2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com