
【题目】甲、乙、丙各取300 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少________?
(2)合金中镁铝的质量分数各是多少________?
【答案】0.20 mol/L 47.1%、52.9%
【解析】
(1)对比甲乙数据,加合金质量为765mg时生气氢气比甲中多,说明甲中盐酸过量,对比乙丙数据,加918mg合金时氢气的体积不变,说明合金已过量,盐酸完全反应;加入918g镁铝合金时,最多只能生成672mL的氢气,说明盐酸最多只能产生672mL的氢气,以此计算盐酸的浓度;
(2)用甲组来计算合金中的镁、铝的物质的量,然后计算出合金中铝的质量分数。
(1)由乙组和丙组可知,最多只能产生672mL的氢气,则氢气物质的量![]() ,氢气中氢元素全部来自盐酸中H+,则
,氢气中氢元素全部来自盐酸中H+,则![]() ,则盐酸的物质的量浓度
,则盐酸的物质的量浓度![]() ,故答案为:0.20 mol/L;
,故答案为:0.20 mol/L;
(2)由表格可知甲组中盐酸过量,设Mg的物质的量为x,设Al的物质的量为y,由合金质量可知①24x+27y=0.51g;由方程式:![]() ;
;![]() ,和生成的氢气物质的量为
,和生成的氢气物质的量为![]() 可知②x+1.5y=0.025mol。由①②两式可得x=0.01mol;y=0.01mol,则Mg的质量
可知②x+1.5y=0.025mol。由①②两式可得x=0.01mol;y=0.01mol,则Mg的质量![]() ,Mg的质量分数
,Mg的质量分数![]() ,则Al质量分数
,则Al质量分数![]() ,故答案为:47.1%、52.9%。
,故答案为:47.1%、52.9%。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知X的性质与乙酸乙酯相似,是一种具有果香味的合成香料,图为合成X的某种流程:
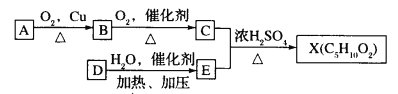
提示:①![]() 不能最终被氧化为一COOH;
不能最终被氧化为一COOH;
②D的产量可以用来衡量一个国家的石油化工水平。
请根据以上信息,回答下列问题:
(1)A的结构简式是_____。分子中官能团的名称是_______
(2)C + E一 X的化学反应类型为________。
(3)C的一种同分异构体F可以发生水解反应,则F的结构简式为_______
(4)反应D-E的化学方程式为__________
(5)与碳酸氢钠溶液反应生成CO2的X的同分异构体有_________
(6)为了制取X,某同学设计如下实验装置:
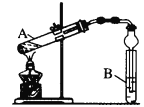
试管B中放入的试剂是_______装置中球形干燥管除起冷凝作用外,另一重要作用是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期主族元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B 形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图:____________________。
(2)写出元素D在元素周期表中的位置:_______________ ;该元素形成的单质的结构式为______。
(3)写出下列物质的电子式:A、B、E形成的化合物 __________________。
(4)A、B两元素组成的化合物A2B2存在的化学键有 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关烷烃的说法中,正确的是( )
A.戊烷的同分异构体有2种,其习惯命名分别为:正戊烷、异戊烷
B.沸点:正丁烷<异丁烷
C.符合通式CnH2n+2(n≥0)的物质一定是烷烃的同系物
D.随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,无限趋近于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H溴丙胺太林(普鲁本辛)属于抗胆碱类药物,用于胃和十二指肠溃疡的辅助治疗,亦用于胃炎、胰腺炎。某合成路线如下:
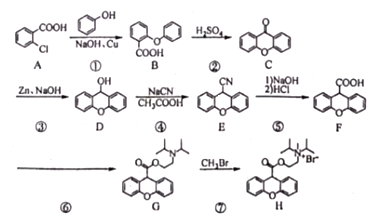
回答下列问题:
(1)A的化学名称为__________,E的分子式为__________________。
(2)①的反应类型为_____________。
(3)反应⑥的化学方程式为________________________________________________。
(4)H中含氧官能团的名称是_____________。
(5)N是D的同分异构体,含有联苯(![]() )结构,可与银氨溶液发生银镜反应,与
)结构,可与银氨溶液发生银镜反应,与![]() 溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
(6)苯乙酸乙酯为合成香料,用于配制各种花香型日用香精。其一种合成路线为:

条件a为__________________,最后一步反应,乙醇稍过量的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g) ![]() CO(g)+2H2(g) △H1=+90.64 kJ/mol
CO(g)+2H2(g) △H1=+90.64 kJ/mol
水蒸气变换反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H2=-41.20 kJ/mol
CO2(g)+H2(g) △H2=-41.20 kJ/mol
则CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H3=____________kJ/mol
CO2(g)+3H2(g) △H3=____________kJ/mol
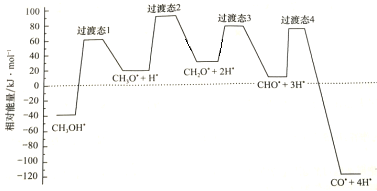
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为________________________________________________。
(3)在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是_____________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,a、c曲线对应物质的化学式分别为_______________、______________。

(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____________MPa/h,其平衡常数分压Kp=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
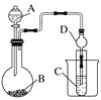
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com