
| A. | 原溶液中投入铁粉物质的量是0.25 mol | |
| B. | 原溶液中HNO3的浓度是2.0 mol•L-1 | |
| C. | 反应后的溶液中还可溶解9.6 g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:2 |
分析 溶液质量增重为参加反应Fe的质量与生成NO的质量之差,再根据电子转移守恒列方程计算溶液中n(Fe2+)、n(Fe3+),进而计算该题.
解答 解:生成NO的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
设Fe2+、Fe3+的物质的量分别为xmol、ymol,
由溶液质量增重9.3g,则:(x+y)mol×56g/mol-0.25mol×30g/mol=9.3g,
由电子转移守恒,则:2xmol+3ymol=0.25mol×3,
联立方程,解得x=0.15、y=0.15,
反应后c(Fe2+):c(Fe3+)为=0.15:0.15=1:1,
A.原溶液中投入铁粉物质的量是0.15mol+0.15mol=0.3mol,故A错误;
B.n(HNO3)=2n(Fe2+)+3n(Fe3+)+n(NO)=2×0.15mol+3×0.15mol+0.25mol=1mol,c(HNO3)=$\frac{1mol}{0.5L}$=2mol/L,故B正确;
C.由反应2Fe3++Cu=2Fe2++Cu2+可知,还可溶解0.075molCu,质量为0.075mol×64g/mol=4.8g,故C错误;
D.由以上计算可知反应后的溶液中c(Fe2+):c(Fe3+)=1:1,故D错误.
故选B.
点评 本题考查氧化还原反应的计算、氧化还原反应基本概念,为高频考点,侧重于学生的分析能力和计算能力的考查,利用电子转移守恒计算,难度中等.


科目:高中化学 来源: 题型:选择题
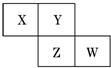 X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的最常见气态氢化物的水溶液显酸性 | |
| B. | 最高价氧化物对应水化物的酸性W比Z强 | |
| C. | Z的单质与氢气反应比Y单质与氢气反应剧烈 | |
| D. | X的原子半径小于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干电池中Zn为负极,炭为正极 | |
| B. | 干电池工作时,电子由Zn极经外电路流向炭极 | |
| C. | 干电池长时间连续使用时内装糊状物可能流出腐蚀电器 | |
| D. | 干电池可以实现化学能向电能的转化和电能向化学能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .已知有机物X的键线式为
.已知有机物X的键线式为 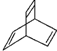 ,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )
,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )| A. | Y的结构简式为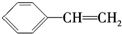 | |
| B. | Y能使溴水褪色,且反应后的混合液静置后不分层 | |
| C. | Y不能发生取代反应 | |
| D. | Y分子中的所有原子一定共面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com