
| A. | 在燃煤中添加石灰石以减少酸雨的发生 | |
| B. | 严格执行机动车尾气排放标准 | |
| C. | 将所有垃圾通过露天焚烧、深埋的方式进行处理 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯可降解塑料代替聚乙烯 |
分析 A.二氧化硫可导致酸雨发生,且CaO与二氧化硫反应;
B.减少尾气排放,减少含N化合物排放;
C.塑料垃圾焚烧产生致癌作用、废旧电池含重金属离子;
D.聚碳酸酯可降解,聚乙烯不能降解.
解答 解:A.二氧化硫可导致酸雨发生,且CaO与二氧化硫反应,则燃煤中添加石灰石以减少酸雨的发生,利用环境保护,故A不选;
B.减少尾气排放,减少含N化合物排放,则严格执行机动车尾气排放标准,利用环境保护,故B不选;
C.塑料垃圾焚烧产生致癌作用、废旧电池含重金属离子,则塑料垃圾不能焚烧、废旧电池不能深埋,故C选;
D.聚碳酸酯可降解,聚乙烯不能降解,则利用二氧化碳等原料合成聚碳酸酯可降解塑料代替聚乙烯,减少白色污染,利用环境保护,故D不选;
故选C.
点评 本题考查三废处理及环境保护,为高频考点,把握常见的环境污染物、环保问题为解答的关键,侧重分析与应用能力的考查,注意化学与生活、环境的联系,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 试纸在检测溶液时不需要湿润,而检测气体时必须湿润 | |
| B. | 焰色反应使用的铂丝通常可用稀硫酸清洗 | |
| C. | 碘水中的碘可以用酒精萃取 | |
| D. | 在实验室遇酸灼伤,用水洗后再用稀NaOH溶液浸洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
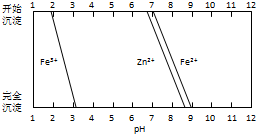 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 石墨转化成金刚石的反应是吸热反应 | |
| C. | △H3=△H1-△H2 | |
| D. | △H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .正常条件下,pH值小于5.6的降雨是“酸雨” | |
| B. | 冰岛火山喷发含有大量SO2,在局部区域形成酸雨 | |
| C. | 全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害 | |
| D. | 汽车尾气含有氮氧化合物,过量排放形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
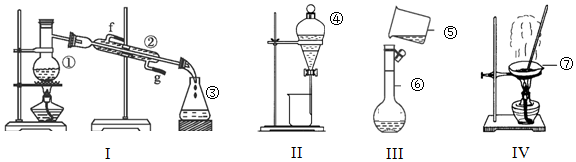
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH 和 CH3COOH 互为同系物 | |
| B. | 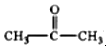 与CH3CH2CHO互为同分异构体 与CH3CH2CHO互为同分异构体 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| D. | 烷烃CH3CH(CH3)C(CH3)3的名称是2,3,3-三甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com