
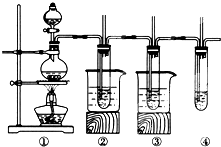
 在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.| 实验现象 | 原因 |
| 溶液最初从紫色变为红色 | 氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 最后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
分析 (1)氯气和氢氧化钠反应生成氯化钠和次氯酸钠;
(2)由于氯气与水反应,即Cl2+H2O=Cl-+H++HClO,由于氯水显酸性,则氯水能使紫色石蕊试液变成红色,而后由于氯水中存在次氯酸,次氯酸具有漂白性,可以使红色石蕊试液退成无色;
(3)缺少尾气处理装置.
解答 解:(1)氯气和氢氧化钠反应生成氯化钠和次氯酸钠,化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯气通入紫色石蕊试液,由于氯气与水反应,即Cl2+H2O=Cl-+H++HClO,由于氯水显酸性,则氯水能使紫色石蕊试液变成红色,而后由于氯水中存在次氯酸,次氯酸具有漂白性,可以使红色石蕊试液退成无色,此后,由于氯气继续通入溶液,通入的氯气不再继续表现氧化性,而是要溶解在水中,最终形成氯水,其颜色呈现黄绿色或浅黄绿色,故答案为:
| 实验现象 | 原因 |
| 红 | |
| 氯气与水反应生成HClO具有漂白性 | |
| 浅黄绿 | 过量氯气溶解于水中 |
点评 本题把氯气的实验室制法、氯气的性质、氯水的性质等结合起来,把已学知识与信息给予结合起来,较大力度地训练了学生结合已有知识与题给信息解题的能力,对学生的思维能力要求较高,值得作为典型题目细心研究,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在铜作催化剂的条件下加热和空气反应得乙醛 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在浓硫酸作用下,乙醇和乙酸共热的反应 | |
| D. | 在浓硫酸作用下.苯在55℃左右与浓硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出,不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol,说明这三种金属的活泼性为:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与稀H2SO4 | B. | NaOH溶液与醋酸 | ||
| C. | Fe(OH)3溶液与稀H2SO4 | D. | Ba(OH)2溶液与稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
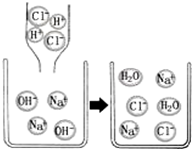
| A. | 反应前后所有元素种类不变 | |
| B. | 恰好反应后溶液的pH大于7 | |
| C. | 反应前的溶液可导电,反应后的溶液不导电 | |
| D. | 中和反应的实质是Na+和Cl-反应生成NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com