
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(Cl-)>c(H+)>c(NH4+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D. | c(OH-)>c(H+)>c(Cl-)>c(NH4+) |
分析 A、若为NH4Cl溶液,NH4+离子水解溶液呈酸性,水解程度很小,则符合;
B、若为NH4Cl、HCl混合溶液,HCl浓度远大于NH4Cl浓度,则符合;
C、任何电中性溶液,都必须遵循电荷守恒,c(Cl-)+c(OH-)=c(H+)+c(NH4+),显然在两对阴、阳离子浓度比较中,结果不可能相同.即不可能有:c(Cl-)>c(NH4+)、c(OH-)>c(H+) 或c(NH4+)>c(Cl-)、c(H+)>c(OH-);
D、任何电中性溶液,都必须遵循电荷守恒,c(Cl-)+c(OH-)=c(H+)+c(NH4+),显然在两对阴、阳离子浓度比较中,结果不可能相同.即不可能有:c(Cl-)>c(NH4+)、c(OH-)>c(H+) 或c(NH4+)>c(Cl-)、c(H+)>c(OH-),据此判断.
解答 解:A、若为NH4Cl溶液,NH4+离子水解溶液呈酸性,水解程度很小,溶液中离子浓度c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A正确;
B、若为NH4Cl、HCl混合溶液,HCl浓度远大于NH4Cl浓度,溶液中离子浓度c(Cl-)>c(H+)>c(NH4+)>c(OH-),故B正确;
C、任何电中性溶液,都必须遵循电荷守恒,即:c(Cl-)+c(OH-)=c(H+)+c(NH4+),显然在两对阴、阳离子浓度比较中,结果不可能相同,即不可能有:c(Cl-)>c(NH4+)、c(OH-)>c(H+),故C错误;
D、任何电中性溶液,都必须遵循电荷守恒,即:c(Cl-)+c(OH-)=c(H+)+c(NH4+),显然在两对阴、阳离子浓度比较中,结果不可能相同,即不可能有:c(Cl-)>c(NH4+)、c(OH-)>c(H+),故D错误.
故选:CD.
点评 本题考查离子浓度大小比较,难度中等,离子浓度大小比较,通常考虑电解质电离、盐类水解、水的电离、电荷守恒、物料守恒、质子恒等式等,注意水解程度很小,弱电解质电离程度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 维生素C能将+5价砷氧化成As2O3 | |
| B. | 维生素C具有还原性 | |
| C. | 青菜中含有维生素C | |
| D. | 生成砒霜的过程中砷元素发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
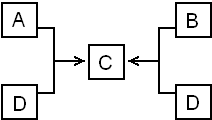 已知A与盐酸反应生成B和氢气.根据右图回答下列问题:
已知A与盐酸反应生成B和氢气.根据右图回答下列问题: ;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.
;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中气体的颜色不变 | B. | 集气瓶中有火星出现 | ||
| C. | 集气瓶内壁上有油状液体出现 | D. | 集气瓶口有棕黄色烟出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 T/℃n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com