
分析 (1)实验有两个过程:配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量:所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等;
(2)KMnO4溶液具有强氧化性,能够腐蚀橡皮管;
(3)根据实验操作对c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$的影响分析误差;
(4)结合2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O计算c,结合Wg草酸晶体及定组成计算x值;
(5)酸性高锰酸钾溶液与草酸溶液发生氧化还原反应.
解答 解:(1)为了准确配制一定浓度浓度的草酸溶液,所需要的实验仪器主要为:天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有:烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,
则在以上操作中不需要的仪器有:e.漏斗 f.锥形瓶,还缺少胶头滴管,
故答案为:ef;胶头滴管;
(2)KMnO4溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故KMnO4溶液应装在酸式滴定管中,故答案为:酸;
(3)在滴定前没有用amol•L-1的KMnO4溶液对滴定管进行润洗,消耗的高锰酸钾偏多,则由2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O计算可知,测定H2C2O4的质量偏大,则H2C2O4•xH2O中水的质量偏小,则x偏小,
故答案为:偏小;
(4)2KMnO4 ~5H2C2O4
2 5
aV×10-3mol 0.025×cmol
c=$\frac{5aV×1{0}^{-3}mol}{2×0.025mol}$=0.1aVmol•L-1,
Wg草酸晶体,配成100.00mL水溶液,取25.00mL进行滴定实验,
则0.1aVmol•L-1×0.1L×(90+18x)=W,
解得x=$\frac{W-0.9aV}{0.18aV}$,
故答案为:0.1aV;$\frac{W-0.9aV}{0.18aV}$;
(5)酸性高锰酸钾溶液滴定草酸溶液过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
点评 本题考查物质含量的测定,为高频考点,把握发生的反应、滴定实验操作和技能、有关计算为解答的关键,侧重分析与计算能力的考查,注意滴定原理的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol水的质量为18g/mol | |
| B. | 标准状况下,3.01×1023个CO2分子的质量为22g | |
| C. | 标准状况下,1mol任何物质体积约为22.4 L | |
| D. | 二氧化硫的摩尔质量是64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔效应可用于鉴别胶体和溶液 | |
| B. | 胶体粒子的直径在1~100 nm之间 | |
| C. | 胶体一定是混合物 | |
| D. | 将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol•L-1的NH4NO3溶液中含有氮原子的数目为2 NA | |
| B. | 22.4L氯气通入足量氢氧化钠溶液中充分反应,转移的电子数为NA | |
| C. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| D. | 4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
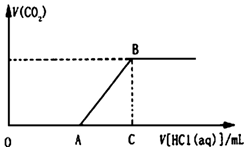 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、Fe2+、MnO4- | B. | Fe3+、Ba2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | Fe3+、H+、SO42-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
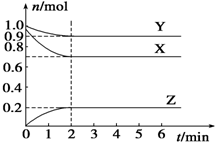 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com