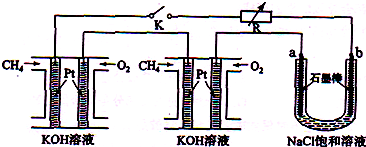
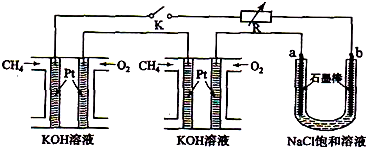
����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH
4��O
2�������ΪKOH��Һ��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б���������ϽҺ���ʵ�飬��ͼ1��ʾ��
�ش��������⣺
��1������ȼ�ϵ�������������ĵ缫��Ӧ�ֱ�Ϊ______��______��
��2���պ�K���غ�a��b�缫�Ͼ����������������Ȼ�����Һ���ܷ�Ӧ����ʽΪ______��
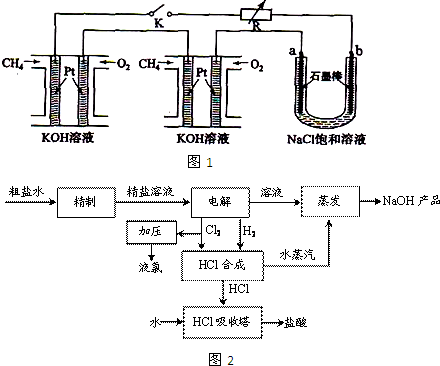
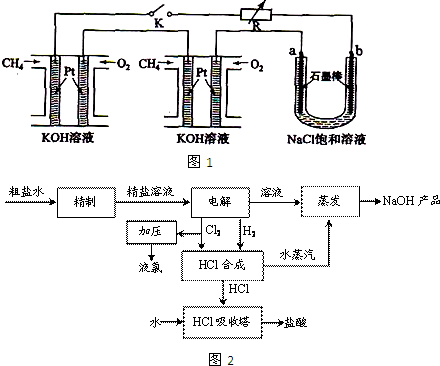
��3���ȼ��ⱥ��ʳ��ˮ��ȡ�ռͬʱ������Ĺ���������ͼ2��
�����������������գ�
�ٴ����к���Ca
2+��Mg
2+��SO
42-�����ʣ�����ʱ�����Լ�Ϊ��A ���B BaCl
2��Һ��C NaOH��Һ��D Na
2CO
3��Һ�������Լ���˳����______��
�ڵ�ⱥ��ʳ��ˮʱ�����Դ���������ĵ缫�Ϸ����ķ�ӦΪ______�����Դ���������ĵ缫������ҺpH______������䡢��С����
��HCl�ϳɷ�Ӧ�б��ֹ�����������______����HCl�ϳ����Ĺ۲���ܹ۲쵽��������______��
������HCl�ϳ�ʱ�ų�������������ˮ����������NaOH��Һ�����������������ŵ���______��
�ݼ���NaOH��Ʒ���Ƿ���NaCl��ʵ�鷽����______��




 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�