
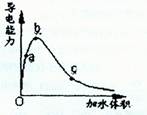
| A.a、b、c三点溶液的pH: c<a<b |
| B.a、b、c三点醋酸的电离程度:a<b<c |
| C.若用湿润的pH试纸测量a处溶液的pH,测量结果偏大 |
| D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
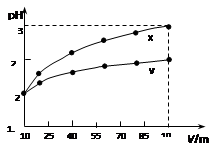
| A.x为弱酸,y为强酸 |
| B.稀释前x、y的物质的量浓度相等 |
| C.随着稀释的进行,y的电离程度减小 |
| D.等体积的x、y分别分别与足量的锌反应,y放出的氢气多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
| 物质 | FeS | MnS | Cus | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-55 | 1.6×10-24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水中NH4+、OH-、NH3·H2O等微粒同时存在 |
| B.1mol/L氨水溶液的pH=10 |
| C.1mol/LNH4Cl溶液的pH=5 |
| D.氨水与AlCl3溶液反应生成Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)和c(OH-)的乘积 | B.c(NH3·H2O)/c(OH-) |
| C.c(NH4+)/c(NH3·H2O) | D.pH值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 者大于后者的是 (多选、错选均不给分,下同);
者大于后者的是 (多选、错选均不给分,下同); ③混合后溶液呈碱性
③混合后溶液呈碱性 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③②④⑤ | B.④③②⑤① | C.③④①②⑤ | D.④⑤②③① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com