
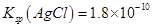 ,
, 。下列关于不溶物之间转化的说法中错误的是:
。下列关于不溶物之间转化的说法中错误的是:A.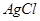 不溶于水,不能转化为 不溶于水,不能转化为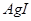 |
B.两种不溶物的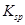 相差越大,不溶物就越容易转化为更难溶的不溶物 相差越大,不溶物就越容易转化为更难溶的不溶物 |
C.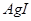 比 比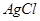 更难溶于水,所以, 更难溶于水,所以,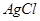 可以转化为 可以转化为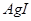 |
D.常温下,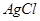 若要在 若要在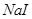 溶液中开始转化为 溶液中开始转化为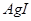 ,则 ,则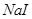 的浓度必须不低于 的浓度必须不低于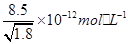 |
科目:高中化学 来源:不详 题型:单选题
 Ba2+(aq)+SO42-(aq) Ksp=c(Ba2+)·c(SO42-),沉淀溶解平衡曲线如图所示。下列说法正确的是
Ba2+(aq)+SO42-(aq) Ksp=c(Ba2+)·c(SO42-),沉淀溶解平衡曲线如图所示。下列说法正确的是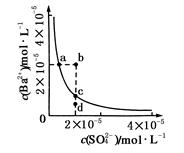
| A.b点时c(Ba2+)·c(SO42-)小于Ksp |
| B.a点对应的Ksp等于c点对应的Ksp |
| C.加水稀释可以使溶液由b点变到c点 |
| D.加入适量的Na2SO4不可能使溶液由a点变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
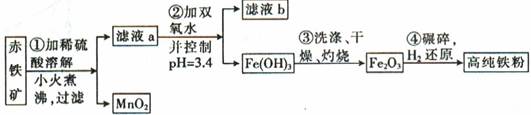

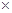 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。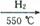 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.温度一定时,Ksp(SrSO4)随c(SO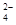 )的增大而减小 )的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2< CuS < CuCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.pH=3时溶液中铁元素的主要存在形式是Fe3+ |
| B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去 |
| C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右 |
| D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
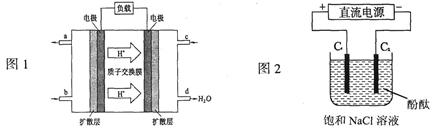
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com