
| A. | 20℃铁片 1mol/L硫酸 | B. | 30℃铁粉 1mol/L硫酸 | ||
| C. | 30℃铁粉 2mol/L硫酸 | D. | 30℃铁片 18mol/L硫酸 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Pt为负极,Zn为正极 | |
| B. | Zn为负极,Pt为正极 | |
| C. | 负极反应式为Zn-2e-═Zn2+,正极反应式为2H++2e-═H2↑ | |
| D. | 负极反应式为Zn-2e-═Zn2+,正极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
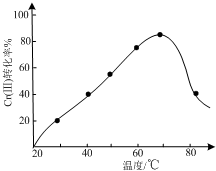 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应③的离子方程式为5Br-+BrO3-+6H+═3Br2+3H2O | |
| B. | ②③的目的是富集溴,提高Br2的浓度 | |
| C. | 蒸馏塔温度控制在90℃左右的原因是防止温度过高将水蒸馏出来 | |
| D. | 从海水中提取任何化学物质都需要经过化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+02(g) $?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6 kJ/mol,则2molSO2完全反应放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 | |
| C. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
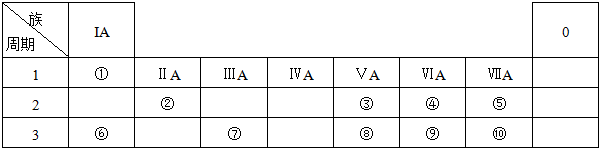
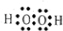
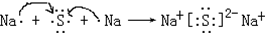
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
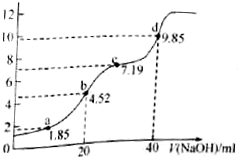 已知:pKa=-LgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19.用0.1mol/L NaOH溶液滴定20mL0.1mol/L H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-LgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19.用0.1mol/L NaOH溶液滴定20mL0.1mol/L H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 mol/L | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | C点所得溶液中:2c(Na+)=3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使酸性KMnO4溶液褪色 | |
| D. | 甲烷与氯气混合,黄绿色消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com