
【题目】现有硫酸铁、硫酸亚铁和硫酸混合溶液200mL,现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生25.63g白色沉淀,往另一份中投入足量铁片,放出1.12L气体(标准状况)。下列判断错误的是( )
A.原溶液中离子有3c(Fe3+)+c(H+)+2c(Fe2+)=2c(SO42-)+c(OH-)
B.原混合液中c(Fe3+)可能为0.1molL-1
C.原混合液中c(H+)=0.5molL-1
D.溶解的铁最多不超过3.92g
【答案】C
【解析】
现有硫酸铁、硫酸亚铁和硫酸混合溶液200mL,现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生25.63g白色沉淀,白色沉淀为硫酸钡,所以溶液当中硫酸根的物质的量为![]() =0.11mol,说明每份溶液中含有0.11mol SO42-;往另一份中投入足量铁片,放出1.12L气体(标准状况下),放出气体为氢气,其物质的量为
=0.11mol,说明每份溶液中含有0.11mol SO42-;往另一份中投入足量铁片,放出1.12L气体(标准状况下),放出气体为氢气,其物质的量为![]() =0.05mol,说明每份溶液中含有H+为0.1mol,由此分析判断。
=0.05mol,说明每份溶液中含有H+为0.1mol,由此分析判断。
A. 根据电荷守恒可知溶液中离子有3c(Fe3+)+c(H+)+2c(Fe2+)=2c(SO42-)+c(OH-),A项正确,不符合题意;
B. 假设溶液为硫酸铁和硫酸的混合溶液,根据电荷守恒列等式:3n(Fe3+)+c(H+)=2n(SO42-)+c(OH-),强酸性溶液中氢氧根离子可忽略不计,得出3n(Fe3+)+0.1mol=0.1mol×2,n(Fe3+)=0.04mol,c(Fe3+)=![]() =0.4mol/L,所以0< c(Fe3+)<0.4mol/L,原混合液中c(Fe3+)可能为0.1mol/L成立,B项正确,不符合题意;
=0.4mol/L,所以0< c(Fe3+)<0.4mol/L,原混合液中c(Fe3+)可能为0.1mol/L成立,B项正确,不符合题意;
C. 原混合液中c(H+)=![]() =1mol/L,C项错误,符合题意;
=1mol/L,C项错误,符合题意;
D. 假设溶液为硫酸铁和硫酸的混合溶液消耗的铁最多,此时n(Fe3+)=0.04mol,根据Fe+2Fe3+=3Fe2+消耗0.02molFe,溶液中的H+的物质的量为0.1mol,Fe+2H+=Fe2++H2↑消耗铁0.05mol,可知消耗Fe的最大物质的量n(Fe)=0.02mol+0.05mol=0.07mol,即消耗铁的质量为0.07mol ×56g/mol=3.92g,D项正确,不符合题意。
故选C。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能
B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动
C.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,对于反应2SiHCl3(g)![]() SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )

A.该反应的正反应活化能大于逆反应活化能
B.a、b处反应速率大小:va大于vb
C.温度一定时使用更优质催化剂,可使k正、k逆增大,k正与k逆的比值增大
D.343K时反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是( )
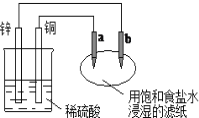
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是( )

A.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1moL·L-1
C.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况
D.Na2CO3溶液中c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.A物质与C物质的反应速率之比为1∶2
B.单位时间内消耗a mol A,同时消耗3a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
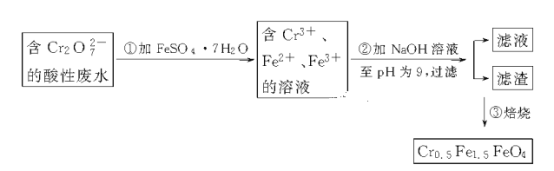
(1)第①步反应的离子方程式是__________________________________________
(2)第②步中用pH试纸测定溶液pH的操作是______________________________
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为______________,加碱调节至pH为________时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________________,原因是________________________________________________。
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染.PETG的结构简式如下:
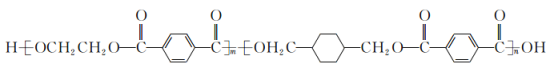
这种材料可采用下图所示的合成路线;
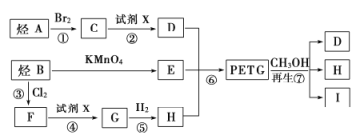
已知;(1)![]()
(2)![]() (R、
(R、![]() 、
、![]() 表示烃基)
表示烃基)
请回答下列问题:
(1)⑦的反应类型是_____________,试剂X为_____________.
(2)写出Ⅰ的结构简式:____________
(3)合成时应控制的单体的物质的量:![]() _____________(用m,n表示).
_____________(用m,n表示).
(4)写出反应②的化学方程式:____________________________________.
(5)与E的分子式相同,且满足下列条件的同分异构体有_____________种.
①能与![]() 溶液反应产生
溶液反应产生![]() ②能发生银镜反应 ③遇
②能发生银镜反应 ③遇![]() 溶液显紫色
溶液显紫色
(6)D和E在催化剂作用下可生产一种聚酯纤维——涤纶,请写出生产该物质的化学方程式:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com