
| A. | 氢氟酸可蚀刻玻璃说明氢氟酸具有强酸性 | |
| B. | 油脂的氢化说明油脂分子中含有不饱和键 | |
| C. | 维生素C常用作抗氧化剂说明它具有氧化性 | |
| D. | 汽车尾气中含有氮氧化物说明汽油中含有氮元素 |
分析 A.HF酸为弱酸,能与二氧化硅反应;
B.油脂的氢化是油脂与氢气的加成反应;
C.维生素C具有还原性;
D.汽车尾气中氮氧化物的产生是由于空气中的氮气与氧气在高温条件下生成的.
解答 解:A.HF酸为弱酸,但能与二氧化硅反应,则氢氟酸可用于雕刻玻璃,故A错误;
B.油脂的氢化是油脂与氢气的加成反应,所以油脂中含有不饱和键,故B正确;
C.维生素C具有还原性,能与氧化剂反应,常用作抗氧化剂,故C错误;
D.汽车尾气中氮氧化物的产生是由于空气中的氮气与氧气在高温条件下生成的,汽油中主要是烃,不含有N元素,故D错误;
故选:B.
点评 本题考查元素化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意反应与现象的分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
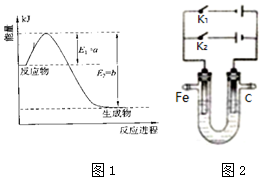 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 操作 | |
| A | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 提纯含有少量苯酚的苯 | 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀 |
| D | 检验蔗糖是否水解 | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | IA族金属元素是同周期中金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
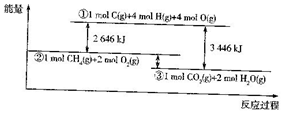 如图表示甲烷和氧气反应过程中的能量变化:请回答下列问题:
如图表示甲烷和氧气反应过程中的能量变化:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
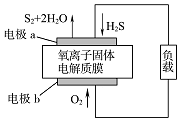 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中的物质 | 预测②中的现象和结论 | 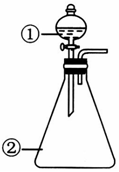 |
| A | 浓盐酸 | 二氧化锰 | 立即产生大量黄绿色气体,证明 HC1具有还原性和酸性 | |
| B | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色,证明草酸具有还原性 | |
| C | 硫酸铝饱和溶液 | 碳酸钠饱和溶液 | 立即产生大量气泡,证明两者相互促进水解 | |
| D | 蒸馏水 | 过氧化钠粉末 | 立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,80gSO3的体积为22.4L | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成28g N2转移的电子数目为3NA | |
| D. | 6.0gSiO2中含有0.1NA个 SiO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com