
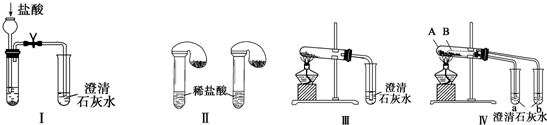
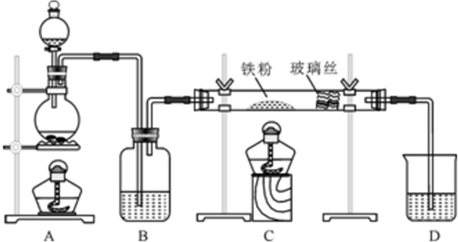
分析 (1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ可以做到用一套装置同时进行两个对比实验,具有较强的对照性;
(3)B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定.
解答 解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O,图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;D;
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,故答案为:NaHCO3.
点评 本题考查了碳酸钠和碳酸氢钠的性质,注意装置与物质性质的关系,明确碳酸钠和盐酸反应分两步进行为解答的关键,侧重二者与酸的反应及稳定性比较的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
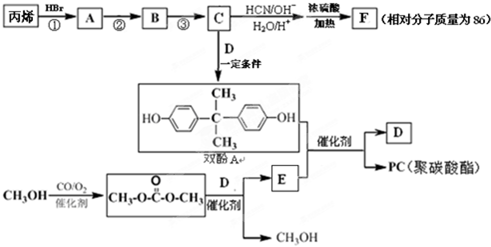
 (R、R′、R″代表羟基)
(R、R′、R″代表羟基) .
.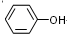 .
. .
.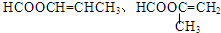 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醇和浓硫酸制乙烯 | B. | 用电解水获得的氢气来合成氨 | ||
| C. | 用晒盐后的卤水制溴单质 | D. | 用氢氧化钠和二氧化碳制碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com