
| A. | 苯、苯的同系物均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 芳香烃可以来自于煤干馏产品中的煤焦油 | |
| D. | 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
分析 A.苯不能使酸性高锰酸钾溶液褪色,但连接苯环的碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
B.甲烷和氯气在光照条件下发生取代反应,溴和乙烯发生加成反应;
C.煤干馏能得到煤焦油,煤焦油中含有芳香烃;
D.乙醇中醇羟基和钠反应,乙酸中羧基和钠反应.
解答 解:A.苯不能使酸性高锰酸钾溶液褪色,但连接苯环的碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以有部分苯的同系物能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A错误;
B.甲烷和氯气在光照条件下发生取代反应生成氯代烃,溴和乙烯发生加成反应生成1,2-二溴乙烷,前者是取代反应、后者是加成反应,所以反应类型不同,故B错误;
C.煤干馏能得到煤焦油,煤焦油中含有芳香烃,所以芳香烃可以来自于煤干馏产品中的煤焦油,故C正确;
D.乙醇中醇羟基和钠反应,乙酸中羧基和钠反应,所以乙醇和乙酸分别与钠反应生成氢气的官能团不同,故D错误;
故选C.
点评 本题考查有机物结构和性质、反应类型及官能团判断,把握官能团及其性质关系是解本题关键,注意能被酸性高锰酸钾溶液氧化的苯的同系物结构特点,题目难度不大.


科目:高中化学 来源: 题型:填空题
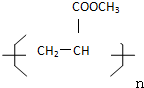
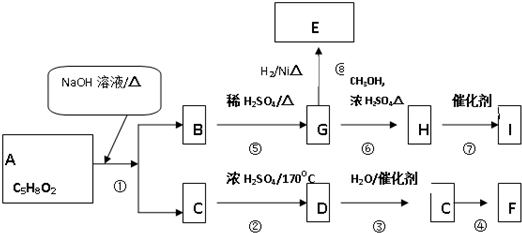
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素基态原最外层有3个未成对电子,最内层有2个电子,其元素符号为N | |
| B. | 某元素的负一价离子的电子层结构与氩相同,其基态原子价电子排布式为[Ne]3s23p5 | |
| C. | 某元素的正三价离子的3d能级为半充满,其基态原子排布式为[Ar]3d64s2 | |
| D. | 某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布式为[Ar]3d54s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Fe2+ | C. | Cu2+ | D. | 无减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.3 mol/L | C. | 0.4 mol/L | D. | 0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照不能够发生取代反应 | ||
| C. | 是石油分馏的一种产品 | D. | 比丁烷更易液化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
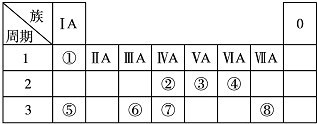
 ,
,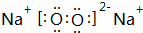 .若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
.若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com