
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
A. 通入少量HCl气体 B. 升高温度
C. 加少量醋酸钠晶体 D. 加水
科目:高中化学 来源: 题型:
【题目】下列生产生活中所采取的措施不能用化学反应速率解释的是
A.有些食物的标签上注明须冷藏B.在糕点制作过程中添加防腐剂
C.在轮胎制品中加入适量的炭黑D.燃煤发电时常用煤粉代替煤块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物(如图)是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是
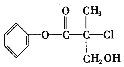
A. 该有机物属于芳香烃
B. 该有机物可以和Br2的CCl4溶液发生加成反应
C. 该有机物和浓硫酸混合加热,可能发生消去反应
D. 1mol该有机物和足量的NaOH溶液反应,最多可与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法正确的是
A. 有的胶体是纯净物,有的胶体是混合物
B. 有的胶体带电,有的胶体不带电
C. 工厂中常用的静电除尘装置是根据胶体的某些性质设计的
D. 胶体、溶液和浊液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示。下列有关混合气体的说法不正确的是
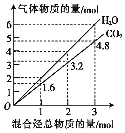
A. 该混合气体中可能含有乙烯或丙炔(C3H4)
B. 该混合气体中一定含有甲烷
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子核外M层上有3个电子,元素Y形成的离子Y2-核外有18个电子,则这两种元素可形成化合物( )
A.XY2B.X2Y3C.X3Y2D.X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在_________(填编号字母)称量。
A、小烧杯中 B、洁净纸片上 C、托盘上
(2)滴定时,用0.2000 mol/L的盐酸标准液来滴定待测溶液,可选用_______(填编号字母)作指示剂。
A、甲基橙 B、石蕊 C、酚酞
(3)滴定过程中,眼睛应注视_______________________________,若用酚酞做指示剂,滴定终点的标志是_____________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol/L,烧碱样品的纯度是_____________。
滴定 次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)若未用待测液润洗盛放标准盐酸的滴定管,则可使测定结果______(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会的进步,性能各异的各种材料的广泛应用大大提高了人们的生活水平。回答下列问题:
(1)橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为体型结构,从而增大橡胶的强度,橡胶属于____(填字母)。
a. 无机非金属材料 b. 金属材料 c. 有机高分子材料
保持洁净安全的生存环境已成为全人类的共识。
(2)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行__________________ 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 ___________________________________________ 。
(3)获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为______________________________ 。
(4)天然水中含有细小悬浮颗粒或胶体颗粒,可以用 ____ (填一种物质的化学式)作为混凝剂净化处理。明矾净水工作原理的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年3月南开大学教授叶萌春及其团队借助廉价金属镍和苯基硼酸共催化的烯基化反应,首次实现烯丙醇高效、绿色合成重大突破。成果也在最新一期《德国应用化学》上发表。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含____molσ键,烯丙醇分子中碳原子的杂化类型为____。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________。
(6)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com