
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
 ;
;分析 由元素在元素周期表中的位置可知,①为H,②为Li,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为Cl,⑩为Ar,(11)为K,(12)为Al,(13)为Br.
(1)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;常温下溴单质为液态;
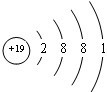
(2)表中(11)为K,原子核外有19个电子,各层电子数为2、8、8、1;
(3)元素非金属性越强,对应氢化物越稳定;
(4)元素非金属性越强,最高价氧化物对应水化物的酸性越强.
解答 解:由元素在元素周期表中的位置可知,①为H,②为Li,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为Cl,⑩为Ar,(11)为K,(12)为Al,(13)为Br.
(1)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中,F元素非金属性最强,K元素金属性追求,而常温下溴元素单质为液态,
故答案为:F;K;Br;
(2)表中(11)为K,原子核外有19个电子,各层电子数为2、8、8、1,原子结构示意图为: ,
,
故答案为: ;
;
(3)非金属性F>Cl>S,故氢化物稳定性:HF>HCl>H2S,
故答案为:HF>HCl>H2S;
(4)非金属性Cl>S,故最高价氧化物对应水化物的酸性:HClO4>H2SO4,
故答案为:HClO4>H2SO4.
点评 本题考查元素周期表和元素周期律,比较基础,熟悉掌握元素在周期表中的位置,能用元素周期律解释有关化学问题.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+1H2O+(1)KOH
+2MnO2↓+1H2O+(1)KOH 与C按1:1生成高分子化合物的反应方程式为
与C按1:1生成高分子化合物的反应方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
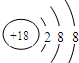 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
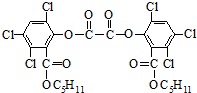
| A. | 草酸二酯属于芳香族化合物 | |
| B. | 1mol草酸二酯最多可与4molNaOH反应 | |
| C. | 草酸二酯难溶于水 | |
| D. | 草酸二酯的分子式为C26H24O8Cl6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 所有的物质中均含有化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com