

【题目】设A、B、C代表三种元素,已知①B2―和A+两种离子具有相同的电子层结构,②C元素的原子核内质子数比B元素的原子核内质子数少8个,③B和C两种元素可形成5个原子核(一般简称5核)50个电子的负二价阴离子(提示为:BC42―或为:CB42―)。据此填空:
(1)写出B和C的元素名称:B为_____________,C为_____________。
(2)有A、B、C三种元素形成的含78个电子的盐类化合物的化学式是______________。
(3)某元素X的原子与A元素形成的化合物的化学式为:AX,通过测量发现的式量为76,X原子核内中子数为20,则X属于的元素名称是_____________,用化学符号表示X原子应该是______________。
【答案】硫 氧 K2SO3 氯元素 ![]()
【解析】
①设A元素的原子核内质子数为a,B元素的原子核内质子数为b,且B2―和A+两种离子具有相同的电子层结构,则a-b=3;
②C元素的原子核内质子数比B元素的原子核内质子数少8个,则c元素的原子核内质子数为b-8;
③B和C两种元素可形成5个原子核(一般简称5核)50个电子的负二价阴离子,若离子微粒为BC42―,则b+4(b-8)+2=50,解得:b=16,即B为硫元素;此时A元素的原子核内质子数为16+3=19,为钾元素;C的质子数为8,为氧元素;
若离子微粒为CB42―,则(b-8)+4b+2=50,b=11.2,质子数均为整数值,不符合,舍去。
由分析知:A为K元素,B为S元素,C为O元素;
(1)B为硫元素,C为氧元素;
(2)已知原子核内质子数等于原子核外电子总数,则有K、S、O三种元素组成的常见盐有K2SO4、K2SO3,其中K2SO3共含有78个电子;
(3)某元素X的原子与K元素形成的化合物的化学式为:KX,通过测量发现的式量为76,则X的相对原子质量为37,质量数为37,由 X原子核内中子数为20,可知X元素的原子核内质子数为37-20=17,则X元素为氯元素,用化学符号表示X原子应该是![]() 。
。


科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17gL-1,常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色![]() 透过钴玻璃
透过钴玻璃![]() ;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系
;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系![]() 其他无关物质已略去
其他无关物质已略去![]() :
:
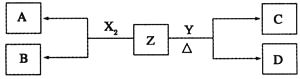
(1)写出单质X2与Z反应的离子方程式:______________________________________。
(2)已知16g单质Y完全燃烧放出148kJ热量。写出热化学方程式:________________。
(3)已知C能与较浓盐酸反应生成能使品红溶液褪色的气体
①D的化学式是:_________;D的水溶液pH>7,原因是![]() 用离子方程式表示
用离子方程式表示![]() :_____________。
:_____________。
②0.1molL-1的D溶液中各离子浓度由大到小的顺序为_______________________。
③将20mL0.5molL-1溶液逐滴加入到20mL0.2molL-1 KMnO4溶液![]() 硫酸酸化
硫酸酸化![]() 中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
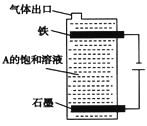
(4)①石墨和铁做电极,用隔膜电解槽电解A的溶液,阳极可产生X2。则铁做_________极。
②按下图电解A的饱和溶液,写出该电解池中较长时间内发生反应的总反应方程式: ________。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配置450毫升 1mol/L的硫酸溶液
(1)应该选择________的容量瓶 A 250毫升 B 500毫升 C 1000毫升
(2)需要量取98%,ρ=1.84g/cm3浓硫酸__________毫升
(3)将所取浓硫酸逐滴加入盛有水的烧杯中,边加边搅拌
(4)将该溶液注入容量瓶
(5)在容量瓶中加水至___________处,改用__________加水至_______与刻度线相切
(6)塞好瓶塞,反复摇匀
(7)摇匀后发现,溶液体积缩小,继续加水至刻度线
(8)该同学的操作是否有不当之处,请指出(不必全部填满)
a__________________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
b____________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
c_______________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
d____________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S(常温下,氢硫酸的Ka1=5.7×10-8,Ka2=1.2×10-15)广泛存在于天然气、合成氨原料气、炼厂气等,生产中需脱硫处理。回答下列问题
(1)著名的 Vanviel反应为2nH2S+nCO2![]() (CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(2)脱除天然气中H2S的工艺流程如下
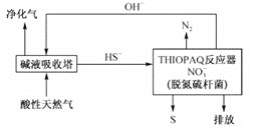
①常温下,“碱液吸收塔”中反应HS-+OH- ![]() S2-+H2O的平衡常数K=________。
S2-+H2O的平衡常数K=________。
②“ THIOPAO”反应器中,在脱氮硫杆菌的作用下,HS-氧化为S的离子方程式为________。
(3)铜(Ⅱ)沉淀及铜(Ⅱ)湿式氧化脱除硫化氢并可回收硫磺,主要步骤如下
(a)吸收H2S
(b)生成CuS沉淀
(c)CuCl2氧化CuS生成单质S和CuCl2-
(d)通O2再生
①常温下,沉淀反应之一:HS-+Cu2+![]() CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
②CuCl2氧化CuS的离子方程式为 ________。
③通O2再生时的离子方程式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.SO2通入已酸化的Ba(NO3)2溶液中
C.NH3通入AlCl3溶液中
D.CO2通入CaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
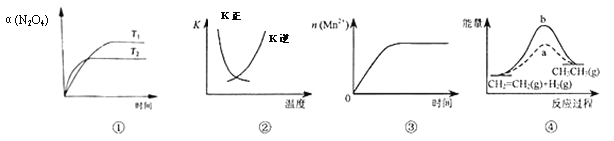
A. 图①表示N2O4(g)![]() 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
B. 图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A+B![]() 3C+4D,表示反应速率最快的是
3C+4D,表示反应速率最快的是
A.VA=0.75mol/(L·s)B.VB=0.5mol/(L·s)C.VC=1.0mol/(L·s)D.VD=1.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.下列说法正确的是( )
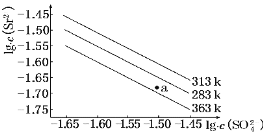
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com