
| A. | 乙烯 | B. | 丙炔 | C. | 丁二烯 | D. | 甲烷 |
分析 这道题可运用极值法:标准状况下4.48LH2物质的量为0.2mol,分别仅与四个选项(杂质)反应时,消耗量分别是:甲烷不反应,可视消耗甲烷无穷多,乙烯5.6g,丙炔4g,1,3-丁二烯5.4g,而氢气单独与乙炔反应时消耗乙炔2.6g,而4<4.16,2.6<4.16,因此气体杂质不可能是丙炔.
解答 解:标准状况下4.48LH2物质的量为0.2mol,分别仅与四个选项(杂质)反应时,消耗量分别是:甲烷不反应,可视消耗甲烷无穷多,乙烯5.6g,丙炔4g,1,3-丁二烯5.4g,而氢气单独与乙炔反应时消耗乙炔2.6g,而4<4.16,2.6<4.16,因此气体杂质不可能是丙炔,故选B.
点评 本题是考查学生运用极值法解题,极值法对于解决一些与量有关的问题是十分简捷,比较容易.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)和c(H+)都减小 | B. | 溶液的PH增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- | |
| B. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| C. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.04mol•L-1 | C. | 0.08mol•L-1 | D. | 0.16mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
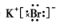 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
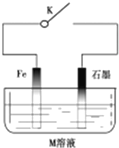
| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com