
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
分析 A、工业上冶炼活泼金属常采用的方法是电解法;
B、铝热反应利用金属铝能用于冶炼难熔的金属(如Cr、V、Mn等);
C、海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④在一定条件下脱水干燥;⑤蒸发结晶;
D、在冶金工业上,Na、Mg、Al、K、Ca常用电解法制备.
解答 解:A、工业上冶炼活泼金属常采用的方法是电解法,电解熔融的氧化铝,故A错误;
B、铝热反应利用金属铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量,故B正确;
C、海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④在一定条件下脱水干燥;⑤蒸发结晶;故C错误;
D、在冶金工业上,Na、Mg、Al、K、Ca常用电解法制备,Zn 能用常用化学还原剂制得,故D错误.
故选C.
点评 本题考查学生金属的冶炼,注意知识的归纳和梳理是关键,难度不大.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
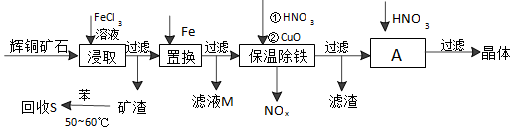
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2═K++Al3++SO42- | B. | NaH2PO4═Na++H2PO4- | ||
| C. | H2S?2H++S2- | D. | NaClO═Na++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
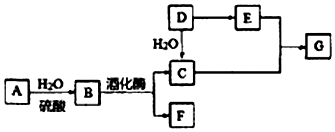
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于3:8 | B. | 大于3:8 | C. | 小于或等于3:8 | D. | 大于3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
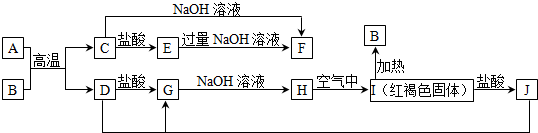
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15NA | B. | 0.6NA | C. | 1.2NA | D. | 2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
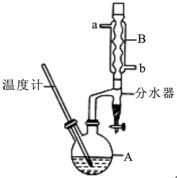 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com