
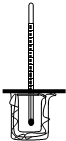
 如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.分析 (1)50.0mL1.0mol/L硫酸中含有硫酸的物质的量为0.05mol,50.0Ml 1.1mol/L 氢氧化钡溶液含有氢氧化钡物质的量为:0.055mol,硫酸少量完全反应
,依据Q=4.18kJ/(kg•℃)×0.100Kg×t计算反应放出的热量,依据方程式书写热化学方程式;
(2)盐酸与氢氧化钠反应实质氢离子与氢氧根离子发生酸碱中和,硫酸与氢氧化钡反应除了发生酸碱中和外,硫酸根离子与钡离子反应生成硫酸钡沉淀,液放出一部分热量,据此解答.
解答 解:(1)依据题意:50.0mL1.0mol/L硫酸中含有硫酸的物质的量为0.05mol,50.0Ml 1.1mol/L 氢氧化钡溶液含有氢氧化钡物质的量为:0.055mol,硫酸少量完全反应生成0.05mol硫酸钡,放出热量为:Q=4.18kJ/(kg•℃)×0.100Kg×t=0.418tKJ,则依据方程式:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l),生成1mol硫酸钡放出热量为:8.36KJt,反应的热化学方程式:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l)△H=-8.36 tkJ/mol;
故答案为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4↓+2H2O(l)△H=-8.36 tkJ/mol;
(2)盐酸与氢氧化钠反应实质氢离子与氢氧根离子发生酸碱中和,离子方程式:H++OH-=H2O,硫酸与氢氧化钡反应除了发生酸碱中和外,硫酸根离子与钡离子反应生成硫酸钡沉淀,液放出一部分热量,硫酸、氢氧化钡分别换为盐酸和氢氧化钠则生成的水为原来一半,所以反应放出热量应小于原来一半,
温度计升高数值小于0.5t;
故答案为:D;H++OH-=H2O.
点评 本题主要考查中和热的测定,明确测定中和热的原理是解题的关键,注意掌握中和热的概念及计算方法、热化学方程式的书写,试题培养了学生的分析能力及化学实验能力,注意中和热与反应热的关系,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:解答题
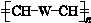 (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: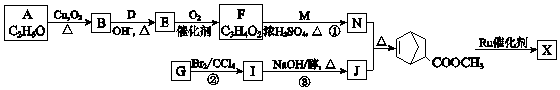
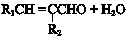
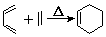
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$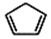 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.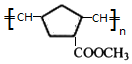 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH约为10; NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
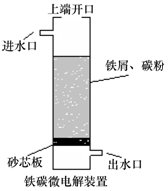
| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 不鼓入空气时,正极的电极反应式为H++e-═H | |
| C. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| D. | 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Cu2O只作氧化剂 | |
| B. | 若有28.8g Cu2O参加反应,则转移电子数为0.2NA | |
| C. | Cu2O的稳定性比CuO弱 | |
| D. | 如果溶液中出现蓝色,说明CuO已分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com