
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、由水电离产生c (H+)=10-10mol/L的溶液:NH4+、AlO2-、Ca2+、S2- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:K+、SO32-、S2-、SO42- |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 |
| B、检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 |
| C、乙醇的消去反应、皂化反应、淀粉的水解反应均可用浓硫酸作催化剂 |
| D、检验氯代烃中的氯元素时,可先加氢氧化钠溶液加热,再加入硝酸溶液,最后加入硝酸银溶液来进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
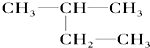 ③金刚石④
③金刚石④35 17 |
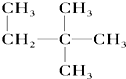 ⑥
⑥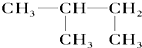 ⑦
⑦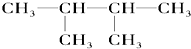 ⑧氯气 ⑨石墨 ⑩
⑧氯气 ⑨石墨 ⑩37 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X能发生取代反应、消去反应、加成反应和水解反应 |
| B、X、Y均能与溴水反应 |
| C、X、Y分子中的所有碳原子可能共平面 |
| D、X、Y均能与饱和碳酸钠溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内每生成 n mol N2,同时生成2 n mol NO |
| B、容器内反应混合物的总压强不随时间改变 |
| C、O2的消耗速率等于NO的消耗速率 |
| D、容器内始终有N2、O2和NO共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠的水解反应:CH3COO-+H3O+?CH3COOH+H2O |
| B、稀H2SO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、Fe(OH)3沉淀中加入足量HI:Fe(OH)3+3H+=Fe3++3H2O |
| D、AlCl3溶液中与过量氨水混合:Al3++3NH3?H2O=3NH4++Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com