
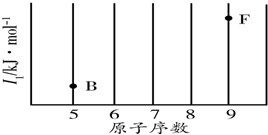
 研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
分析 (1)根据元素的电负性在周期表中的递变规律判断C、Si、N元素的电负性由大到小的顺序;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(3)同周期自左而右元素的第一电离能呈增大趋势,但氮元素的2p能级容纳3个电子,处于半满稳定状态,能力降低,氮元素的第一电离能高于同周期相邻元素;
(4)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(5)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,据此解答.
解答 解:(1)同周期元素从左到右元素的电负性逐渐增强,则电负性:N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>C>Si,故答案为:N>C>Si;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(3)同周期自左而右元素的第一电离能呈增大趋势,但氮元素的2p能级容纳3个电子,处于半满稳定状态,能力降低,氮元素的第一电离能高于同周期相邻元素,故C、N、O三种元素的相对位置为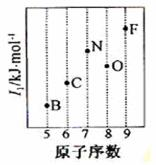 ,故答案为:
,故答案为: ;
;
(4)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(5)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9、电子数为4,
故答案为:M;9;4.
点评 本题考查较为综合,涉及多个方面的知识,题目难度较大,本题注意晶体类型以及对数据的分析和判断,学习中注重相关基础知识和解题方法的积累.


科目:高中化学 来源: 题型:选择题
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 | 甲、乙两种分子一定是同分异构体 |
| C | 致冷剂氟里昂(二氯二氟甲烷)不存在同分异构体 | 甲烷分子为正四面体构型 |
| D | 将C2H5Br与NaOH醇溶液共热后的气体直接通入酸性KMnO4溶液,紫红色褪去 | 使KMnO4褪色的一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.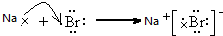 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
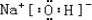 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
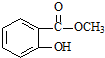 乙
乙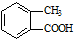 丙
丙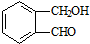


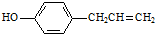 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl→CH2=CH2 | B. |  → → | ||
| C. | CH≡CH→CH2=CH2 | D. | CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚溶液、氨水、氯水 | B. | AgNO3溶液、KBr溶液、K2SO4溶液 | ||
| C. | 苯乙烯、己烯、电石气 | D. | KI溶液、H2S溶液、NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com