
����Ŀ��ʵ��������480mL 0.1molL��1 NaOH��Һ���ش���������
��1��Ӧ��������ƽ��ȡ�������ƹ���g��
��2������NaOH��Һʱ���õ���Ҫ������������ƽ��ҩ�ס��ձ�������������Ͳ�� ��
ʹ������ƿǰ������еIJ����� ��
��3������ʱ����ʵ�������õ��������������÷ֱ����� ��
��4������ʱ����ˮ�����̶��ߣ�Ӧ��δ����� ��
��5���Է������в�����������Һ��Ũ���к�Ӱ�죮
A��ƫ�� B��ƫ�� C�����䣨�÷��Żش�
�ٶ���ʱ���ӿ̶�����
�ڷ�����ֽ�ϳ���NaOH���� ��
������ƿû�и������������ˮ�� ��
�ܶ��ݺӸǵ�תҡ�Ⱥ���Һ����ڿ̶��ߣ��ֵμ�����ˮ���̶ȣ� ��
��6������������Լ�ƿ��ʢ���������ƺõ���Һ���ϱ�ǩ����������ȥ ����ǩ��ͼ����
���𰸡�
��1��2.0
��2��500mL����ƿ,��ͷ�ι�,����Ƿ�©ˮ
��3������,����
��4����������
��5��A,B,C,B
��6��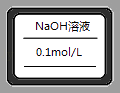
���������⣺��1������480mL 0.1molL��1 NaOH��Һ��Ӧѡ��500ml������ƿ�������������Ƶ����ʵ���n=0.5L��0.1molL��1=0.05mol��������m=0.05mol��40g/mol=2.0g��
��2��ʵ��������480mL 0.1molL��1 NaOH��Һ��Ӧѡ��500ml������ƿ���õ��������У�������ƽ��ҩ�ס��ձ�������������Ͳ��500ml����ƿ����ͷ�ιܣ�ʹ������ƿǰ������еIJ����ǣ�����Ƿ�©ˮ��
��3�����ܽ���������ʱ�ò�����������Լ��ٹ����ܽ⣻����ƿƿ��̫ϸ����Һʱ�ò���������Һ����������ƿ��
��4������ʱ����ˮ�����̶��ߣ�ʵ��ʧ�ܣ������������ã�
��5������C= ![]() ����������ʹnƫС����ʹVƫ��IJ�������ʹ��Һ��Ũ��ƫС����֮����ҺŨ�Ƚ�ƫ��
����������ʹnƫС����ʹVƫ��IJ�������ʹ��Һ��Ũ��ƫС����֮����ҺŨ�Ƚ�ƫ��
�ٶ���ʱ���ӿ̶��ߣ����¼��������ˮ���٣���Һ�����VƫС����Һ��Ũ��ƫ�ߣ���ѡA��
�ڷ�����ֽ�ϳ���NaOH���壬�����������տ����е�ˮ�Ͷ�����̼���������ʵ����ʵ���nƫС����Һ��Ũ��ƫ�ͣ���ѡB��
������ƿû�и������������ˮ�������ʵ���������Һ��������������Ӱ�죬��Һ��Ũ����Ӱ�죬��ѡC��
�ܶ��ݺӸǵ�תҡ�Ⱥ���Һ����ڿ̶��ߣ��ֵμ�����ˮ���̶ȣ�������Һ�����Vƫ����Һ��Ũ��ƫ�ͣ���ѡB��
��6�����Լ�ƿ��װ����NaOH��Һ�������ʵ���Ũ��Ϊ0.1mol/L����ǩΪ  ��
��
���Դ��ǣ���1��2.0����2��500ml����ƿ����ͷ�ιܣ�����Ƿ�©ˮ����3�����裻��������4���������ƣ���5����A ��B ��C ��B����6�� 
�����㾫�����������⣬������Ҫ�˽�����һ�����ʵ���Ũ�ȵ���Һ(�������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶���)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���᳧������SO2�Ļ������÷�����ͼ��ʾ������˵������ȷ���ǣ� �� 
A.X���ܺ���2����
B.a��SO3
C.Y���ܺ��У�NH4��2SO4
D.��NH4��2S2O8��S�Ļ��ϼ۲�����Ϊ+7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�ɼ��Լ����ɵķ���ȫ���Ǽ��Է���
B.���зǼ��Լ��ķ���һ���ǷǼ��Է���
C.���Է���һ�����м��Լ����Ǽ��Է���һ�����зǼ��Լ�
D.�Լ��Լ���ϵ�˫ԭ�ӷ��ӣ�һ���Ǽ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������գ���Ŀǰ����ˮ���塱������Ҫ����֮һ���乤��������ͼ��ʾ�����в���ȷ���ǣ� �� 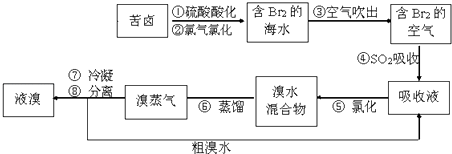
A.����ܢ���Ϊ�˸�����
B.�����˵������лӷ���
C.����ܵ����ӷ���ʽΪBr2+SO2+H2O�T2H++2Br��+SO32��
D.�������������������õ�Һ������ˮ�Ļ������÷�Һ©������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У��������
A. ��ѧ��Ӧ�У��з��ȷ�ӦҲ�����ȷ�Ӧ
B. ú��ʯ�͡���Ȼ���ǵ�����������Ҫ�����ֻ�ʯȼ��
C. Ba(OH)2��8H2O��NH4Cl����ķ�Ӧ�����ȷ�Ӧ
D. ��ѧ��Ӧ�������仯�Ĵ�С�뷴Ӧ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۼ������Ӽ��ͷ��Ӽ��������ǹ������ʵ�����IJ�ͬ���÷�ʽ�����������У�ֻ��������һ�����õ��ǣ� ��
A. �ɱ�B. �Ȼ���C. �������� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ö������̺�Ũ����������ʱ����ѡ�õĸ������ ( )
A. Ũ���� B. ��ʯ�� C. ����NaOH D. ����NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������CuZnO���������£�CO2��H2�ɷ�������ƽ�з�Ӧ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£� CO2��g��+3H2��g��CH3OH��g��+H2O��g����H1 ƽ�ⳣ��K1 ��Ӧ��
CO2��g��+H2��g��CO��g��+H2O��g����H2=+41.2kJmol��8ƽ�ⳣ��K2 ��Ӧ��
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1��2.2������ͬѹǿ�£�������ͬ��Ӧʱ�������ʵ�����ݣ�
T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[��ע]Cat.1��Cu/ZnO���װ���Cat.2��Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
��1���ϳɵļ״�������ȼ�ϵ�ص�ȼ�ϣ��������Ϊϡ�ռ���Һʱ�״�ȼ�ϵ�ص�������ӦʽΪ���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ�����������õ缫��Ӧʽ�� ��
��2���ӱ���ʵ�����ݿ��Է����������CO2ת����CH3OH��ѡ���Եķ����� ��
��3����ӦCO��g��+2H2��g��CH3OH��g����ƽ�ⳣ��K3=����K1��K2��ʾ����
��4���ں�ѹ�ܱ������У���CO2��H2���з�ӦI�ϳɼ״����������������������£�̽���¶ȶԻ�ѧƽ���Ӱ�죬ʵ������ͼ�� �١�H10�����������������=����
�����������CO2ƽ��ת���ʵĴ�ʩ�������ţ���
A�����ͷ�Ӧ�¶�
B��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
C������CO2��H2�ij�ʼͶ�ϱ�
D����������в���һ�����������壨�����뷴Ӧ��
��5����T1�¶�ʱ����1.00molCO2��3.00molH2�������Ϊ1.00L�ĺ����ܱ������У�������ʼѹǿΪP0 �� �����з�ӦI�� �ٳ�ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa����������ѹǿ����ʼѹǿ֮��Ϊ����a��ʾ����
��������3h��Ӧ�ﵽƽ�⣬ƽ�����������ʵ���Ϊ3.00mol����ù�����H2��ƽ����Ӧ����Ϊ��������λ��Ч���֣������¶��·�Ӧ�Ļ�ѧƽ�ⳣ��KΪ��������λ��Ч���֣���ƽ�ⳣ��K���÷�Ӧ��ϵ���������ʷ�ѹ��ʾ����K����ʽ����ƽ���ѹ����ƽ��Ũ�ȣ���ѹ=��ѹ�����ʵ���������д��������Ӧѹ��ƽ�ⳣ��KPΪ����P0��ʾ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���Na����H����Cl������Һ�У������ܴ������ڵ��ǣ� ��
A. OH�� B. Ag�� C. K�� D. CO32��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com