
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,关于这两种晶体的说法,正确的是( )
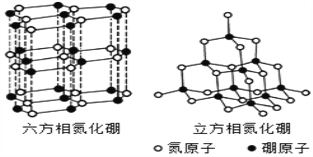
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中硼原子和氮原子之间的作用力不同
D. 两种晶体均为分子晶体
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
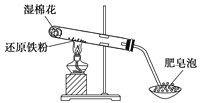
(1)试管中发生反应的化学方程式为_______________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是: __________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式__________________________________________________,______________________________________。
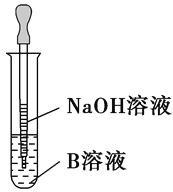
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________________________________,并且配制时应加入少量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据等电子原理判断,下列说法中错误的是( )
A. B3N3H6(比例模型如图)分子中所有原子均在同一平面上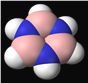
B. B3N3H6分子中存在双键,可发生加成反应
C. H3O+和NH3是等电子体,均为三角锥型
D. CH4和NH4+是等电子体,均为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述不正确的是( )
A. 漂白粉的有效成分是Ca(ClO)2和CaCl2
B. 漂白粉在空气中久置后能变质
C. 漂白粉是由Cl2与石灰乳制得
D. 为了增强漂白粉的漂白效果,使用时可以加少量稀醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3—>I—,氧化性IO3—>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是
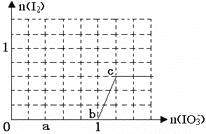
A. 0~a间发生反应:3HSO3—+IO3—=3SO42-+I—+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含有 NO、 CO2、NO2、NH3、N2 中的某几种。将 100 mL 甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )

A. NH3、NO2、N2 B. NH3、NO2、CO2 C. NH3、NO、CO2 D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com