
【题目】α-AgI是一种固体导体,导电率很高。为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )

A.若α-AgI是Ag+导电,则通电一段时间后晶体质量不变
B.若α-AgI是Ag+导电,则通电一段时间后晶体质量减少
C.阳极反应为:Ag-e-===Ag+
D.阴极质量不断增加
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应: 2X(g) ![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为_____________mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol/(L·min); 乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075 mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)_________;
(3)若向达到(1)的平衡体系中充入氮气,则平衡向_____(填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向_____(填“左”或“右”或“不”)移动;
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较:_____________
A.无法确定
B.前者一定大于后者
C.前者一定等于后者
D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为___________________;
(6)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)与氮同一主族,As原子比N原子多两个电子层。可以形成As2S3、As2O5、H3AsO3、H3AsO4,等化合物,有着广泛的用途。回答下列问题:
(1)As的原子序数为______________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式____________。该反应需要在加压下进行,原因是___________。
(3)己知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)
H2(g)+2O2(g)=H3AsO4(s) ![]()
H2(g)+![]() O2(g)=H2O(l)
O2(g)=H2O(l) ![]()
2As(s)+![]() O2(g)=As2O5(s)
O2(g)=As2O5(s) ![]()
则反应As2O5(s)+3 H2O(l)=2 H3AsO4(s)的![]() =______________________。
=______________________。
(4)298K肘,将2OmL 3xmol·L-1 Na3AsO3、20m L3xmol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
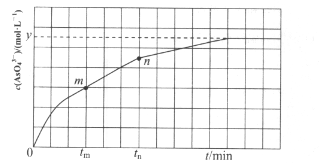
①下列可判断反应达到平衡的是_____(填标号)。
a.v(I-)=2v(AsO33-) b.溶液的pH不再变化
c.c(I-)=ymol·L-1 d.c(AsO43-)/c(AsO33-)不再变化
②tm时,v正____v逆(填“大于”、“小于”或“等于”)。
③) tm时v逆____tn时v逆(填“大于”、“小于”或“等于”),理由是___________。
④若平衡时溶液的pH=14,则该反应的平衡常数为_____(用x、y表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示:

(1)由A、C点判断,滴定HCl溶液的曲线是__(填“图1”或“图2”)。
(2)a=___mL。
(3)c(Na+)=c(CH3COO-)的点是_______。
(4)E点对应离子浓度由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 水、乙醇、乙酸都属于弱电解质
B. 苯与氯气生成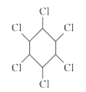 的反应属于取代反应
的反应属于取代反应
C. 分子式为C9H12的芳香烃共有8种
D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com