
| A. | $\frac{a+b-2c}{4}$kJ | B. | $\frac{a+2b-4c}{8}$kJ | C. | $\frac{b-a-2c}{4}$kJ | D. | $\frac{2b-a-4c}{8}$kJ |
分析 先设H-Cl键的键能为XkJ/mol,H-O键的键能为YkJ/mol,然后根据反应热=反应物的总键能-生成物的总键能来解答.
解答 解:在反应4HCl+O2═2C12+2H2O中,已知2molO2被还原时,放出akJ的热量,则1molO2被还原时,放出$\frac{a}{2}$kJ的热量,设H-Cl键的键能为XkJ/mol,H-O键的键能为YkJ/mol,因反应热=反应物的总键能-生成物的总键能,所以-$\frac{a}{2}$kJ/mol=4XkJ/mol+bkJ/mol-2ckJ/mol-4YkJ/mol,所以Y-X=$\frac{a+2b-4c}{8}$,则断开1mol H-0键比断开1mol H-Cl键所需能量高$\frac{a+2b-4c}{8}$kJ.故选:B.
点评 本题主要考查了反应热与键能的关系,掌握反应热=反应物的总键能-生成物的总键能是解题的关键,难度不大.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
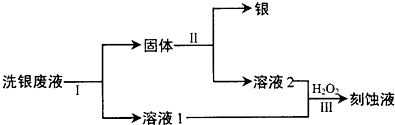
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
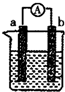 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3
(1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com