
| A、钙沸石[Ca(Al2SiO10)?3H2O]:CaO?Al2O3?3SiO2?3H2O | B、镁橄榄石[Mg2SiO3]:2MgO?SiO2 | C、正长石[KAlSi3?O8]:K2O?Al2O3?3SiO2 | D、高岭石[Al2(Si2O5)(OH)4]:Al2O3?2SiO2?2H2O |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)
(1)铝是一种重要的金属材料,铝热反应可以焊接钢轨,请写出铝在高温下与三氧化二铁反应的化学方程式
(2)某铝合金中含有合金元素镁、铜、硅,为了测定合金中铝的含量,设计了如下实验,请回答有关问题:
①称取样品ag,将样品溶于足量的稀盐酸,过滤;
②滤液中加入过量的氢氧化钠溶液,过滤,有关的离子方程式为:
③步骤②的滤液中通过足量的CO2气体,可产生Al(OH)3沉淀
④步骤③过滤后的滤渣用蒸馏水洗涤数次, 烘干并灼烧至恒重,冷却后称量,其质量为bg,原样品中铝的质量分数为
(3)工业上,硅是在电炉中用炭粉还原二氧化碳硅制得的,写出该反应的化学方程式
,若往电炉中加入12g二氧化硅和足量炭粉的混合物,生成的气体在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津市高三第三次月考三化学试卷 题型:选择题
下列叙述中,正确的是
①纯铁比碳素钢易生锈
②大量燃烧含硫燃料是形成酸雨的主要原因
③硅是光导纤维和制造太阳能电池的主要原料
④可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C>Si
⑤氯水和过氧化钠都具有漂白作用,其漂白原理相似
⑥用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
⑦日本福岛核电站泄露的放射性核素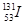 和
和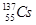 ,前者比后者少8个中子
,前者比后者少8个中子
⑧Al2O3在工业上用于制作耐高温材料,也有于电解法冶炼铝金属
A.①⑤⑥⑦ B.②③⑤⑦ C.③④⑤⑥ D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源:重庆市2010届高三下学期5月月考(理综化学部分) 题型:选择题
下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是
A.用氯气和消石灰制漂白粉 B.铝热法冶炼金属钒
C.用石灰石、纯碱、二氧化硅制玻璃 D.电解饱和食盐水制烧碱
查看答案和解析>>
科目:高中化学 来源:2010年北京市高三上学期起点考试化学试题 题型:填空题
(10分)
(1)铝是一种重要的金属材料,铝热反应可以焊接钢轨,请写出铝在高温下与三氧化二铁反应的化学方程式
(2)某铝合金中含有合金元素镁、铜、硅,为了测定合金中铝的含量,设计了如下实验,请回答有关问题:
①称取样品ag,将样品溶于足量的稀盐酸,过滤;
②滤液中加入过量的氢氧化钠溶液,过滤,有关的离子方程式为:
③步骤②的滤液中通过足量的CO2气体,可产生Al(OH)3沉淀
④步骤③过滤后的滤渣用蒸馏水洗涤数次, 烘干并灼烧至恒重,冷却后称量,其质量为bg,原样品中铝的质量分数为
(3)工业上,硅是在电炉中用炭粉还原二氧化碳硅制得的,写出该反应的化学方程式
,若往电炉中加入12g二氧化硅和足量炭粉的混合物,生成的气体在标准状况下的体积为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com