
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=﹣57.3kJ•mol﹣1,则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3)kJ•mol﹣1
B.CO(g)的燃烧热是283.0 kJ•mol﹣1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol﹣1
C.需要加热才能发生的反应一定是吸热反应
D.乙烷的燃烧热就是1mol乙烷燃烧生成气态水和二氧化碳所放出的热量
考点:反应热和焓变.
专题:化学反应中的能量变化.
分析:A.强酸和强碱的稀溶液中和生成1mol水时放出的热量,是中和热,注意只生成水;
B.燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,反应热与方程式的计量数成正比放出反写时,反应热的符号相反;
C.反应是吸热还是放热反应与反应条件无关;需要加热才能发生的反应不一定为吸热反应,有些放热反应必须在加热条件下才能进行;
D.燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,应生成液态水.
解答: 解:A.强酸和强碱的稀溶液中和生成1mol水时放出的热量是中和热,HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1,生成沉淀也要放热,则H2SO4和Ba(OH)2的反应放出的热量大于2×57.3kJ,则△H<2×(﹣57.3)kJ•mol﹣1,故A错误;
B.CO(g)的燃烧热是283.0 kJ•mol﹣1,则2CO(g)+O2(g)=2CO2(g)的△H=2×(﹣283.0)kJ•mol﹣1,所以2CO2(g)=2CO(g)+O2(g)的△H=2×(+283.0)kJ•mol﹣1,故B正确;
C.需要加热才能发生的反应不一定为吸热反应,有些放热反应必须在加热条件下才能进行,如铝热反应,故C错误;
D.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,应生成液态水,则1 mol乙烷燃烧生成气态水和二氧化碳所放出的热量不是乙烷的燃烧热,故D错误.
故选B.
点评:本题综合考查了焓变与反应热、中和热、燃烧热等知识,为高频考点,侧重于基本概念的综合理解和运用的考查,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:
利用右图实验装置,能得出相应实验结论的是( )
① ② ③ 实验结论 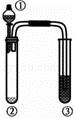
A 浓醋酸 CaCO3 Ca(ClO)2 酸性:醋酸>碳酸>次氯酸
B 浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性
C 浓硫酸 CuS KMnO4 H2S具有还原性
D 盐酸 Na2CO3 Na2SiO3 非金属性:Cl>C>Si
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活有着密切联系,以下生活中的做法正确的是( )
A.用燃烧的方法鉴别真丝围巾和纯棉围巾
B.用铝制容器长时间存放醋、酸梅汤、碱水等
C.用福尔马林(35%~40%甲醛水溶液)浸泡海产品,防腐保鲜
D.在食品中添加大量的人工合成色素,以提高食品的营养价值
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年上海世博会主题是“城市,让生活更美好”,试回答下列问题:
(1)为确保世博会期间申城空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是 .
a.可吸入颗粒物(PM10)b.NO2浓度 c.SO2浓度 d.CO2浓度;
(2)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 .
(3)为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入KAl(SO4)2•12H2O或碱式氯化铝的作用是 ;通入臭氧或二氧化氯的作用是消毒剂.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为 .
(4)近日,世博会中国馆﹣﹣“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成.其中部分玻璃为石英玻璃,它化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用石墨作阳极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)⇌H2(g)+I2(g)已达到平衡的标志是( )
A.c(HI):c(H2):c(I2)=2:1:1时
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和体积一定时,混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
结合图判断,下列叙述正确的是( )
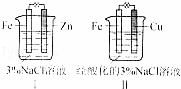
A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置
B.Ⅰ和Ⅱ中负极反应均是Fe﹣2e﹣=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e﹣=4OH﹣
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣
3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2⇌KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是(用化学式表示);CCl4中显紫红色的物质 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.
写出潮湿环境下KI与氧气反应的化学方程式: .
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com